题目内容
15.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如表变化:| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于NaHCO3的水解程度(填“大于”或“小于”).
丙同学认为甲、乙的判断都不充分.丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)的判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10℃,若溶液的pH等于8.3(填“高于”、“低于”或“等于”),则甲(填“甲”或“乙”)判断正确.
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液溶液的温度达不到150℃.
(4)关于NaHCO3饱和水溶液的表述正确的是a.
a.c(Na+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(OH-)
c.HCO${\;}_{3}^{-}$的电离程度大于HCO${\;}_{3}^{-}$的水解程度.
分析 NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,加热时,NaHCO3可分解生成Na2CO3,Na2CO3水解程度较大,溶液碱性较强;
(1)加入氯化钡溶液后,如生成沉淀,说明乙同学结论正确;
(2)将加热后的溶液冷却到10℃,若溶液的PH等于8.3,说明碳酸氢钠没有分解;
(3)常压下加热NaHCO3的水溶液,溶液的温度达不到150℃;
(4)据NaHCO3饱和水溶液中存在电荷守恒、物料守恒,碳酸氢钠溶液显碱性.
解答 解:NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,加热时,NaHCO3可分解生成Na2CO3,Na2CO3水解程度较大,溶液碱性较强,
故答案为:大于;
(1)加入氯化钡溶液后,如生成沉淀,说明溶液中存在大量的CO32-,乙同学结论正确,而加入A、D都生成沉淀,不能正确,加入C无现象,故答案为:乙;B;
(2)将加热后的溶液冷却到10℃,若溶液的PH等于8.3,说明碳酸氢钠没有分解,则甲正确,故答案为:等于;甲;
(3)如NaHCO3的分解温度为150℃,则乙的结论肯定错误,原因是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃,
故答案为:乙;常压下加热NaHCO3的水溶液,溶液的温度达不到150℃;
(4)据NaHCO3饱和水溶液中存在电荷守恒,则有c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-),存在物料守恒,则有c(Na+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(H2CO3),碳酸氢钠溶液显碱性,说明HCO${\;}_{3}^{-}$的电离程度小于HCO${\;}_{3}^{-}$的水解程度,故答案为:a.
点评 本题考查较为综合,涉及盐类的水解和实验方案的评价,侧重于学生的实验能力和评价能力的考查,注意把握盐类水解的原理和规律,把握物质的性质,难度不大.

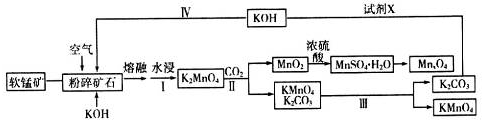
请回答下列问题:
(1)K2MnO4中锰元素的化合价是+6.
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(3)分析下表数据.工业上采用Ⅲ得到较纯净的高锰酸钾,Ⅲ中包含的操作名称是蒸发结晶、过滤、洗涤、干燥.
| 温度/℃ 溶解度/g | 10 | 20 | 30 | 40 | 60 |
| KC2O3 | 107 | 109 | 111 | 114 | 126 |
| KMnO4 | 2.83 | 4.31 | 6.34 | 9.03 | 12.6 |
(5)通过煅烧MnSO4•H2O可制得软磁铁氧体材料MnxO4.下图是煅烧MnSO4•H2O时温度与剩余固体质量变化的曲线.该曲线中A段所表示物质的化学式是MnSO4;MnxO4中x=3.


则下列说法不正确的是( )
| A. | 路线①②③是工业生产硝酸的主要途径 | |
| B. | 路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 | |
| C. | 上述所有反应都是氧化还原反应 | |
| D. | 上述反应中只有③属于氮的固定 |
①I2(?)+H2(g)?2HI(g)△H═-9.48kJ•mol-1
②I2(?)+H2(g)?2HI(g)△H═+26.48kJ•mol-1
下列判断中正确的是( )
| A. | ①中的I2为固态,②中的I2为气态 | B. | 254 g I2(g)完全反应放热9.48 kJ | ||
| C. | ①的产物比②的产物热稳定性更好 | D. | 1 mol固态碘升华时将吸热17 kJ |
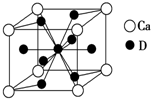 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: 某同学做如图实验,以检验反应中的能量变化.
某同学做如图实验,以检验反应中的能量变化.