��Ŀ����
����Ŀ���о���̼������Ľṹ�����ʣ������������еȾ�����Ҫ����
(1)�������ɶ����Ԫ������֮��ʧˮ�γɵĻ�״�����X��Y��Z�dz��������ֹ��ѣ���ṹ��ͼ��ʾ���������������������ã��������Ż��Ĵ�С��ͬ���벻ͬ�����������á�

��Li+����X�Ŀ�ǻ��С�����ǡ���ܽ��뵽X�Ļ��ڣ���Li+����ԭ�ӵ�һ�Թµ��Ӷ������γ��ȶ��ṹW(��ͼ)��
a.��̬����Ӻ���������ߵĵ��������ܲ����Ϊ___________��
b.W��Li+��¶Ե���֮�����������___________(ѡ����ĸ���)
A.���Ӽ� B.���ۼ� C.��λ�� D.��� E.���϶�����
�ڹ���Y����K+�γ��ȶ��ṹ����������Li+���γ��ȶ��ṹ��������___________��
��ϩ��������ˮ����KMnO4ˮ��Һ������Ч���ϲ��ϩ�������˹���Z������Ч������������
i.ˮ�����������ӻ�����Ŀռ乹����___________��H��O������___________(������������������=��)109��28��
ii.��֪������Z��KMnO4���Է�����ͼ��ʾ�ı仯���������Z��ϩ��������Ч������������ԭ����___________��
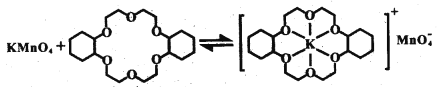
(2)��������Ҫ�������Դ���侧��ṹ��ͼ��ʾ����������Ϊanm��
�ٳ��³�ѹ�²����ڼ��龧�塣����������õĽǶȽ��ͣ���������___________��
�ڼ�����ӵ���λ��Ϊ___________��
��A������̼ԭ�ӵ��������Ϊ(0��0��0)����B���ӵ�̼ԭ�ӵ��������Ϊ___________��
�ܼ��龧����ܶ�Ϊ___________(g��cm��3)��

���𰸡�K C Li+�뾶��Y�Ŀ�ǻС�ö࣬�������ǻ����ԭ�ӵŵ��Ӷ������γ��ȶ��ṹ �������� С�� ���ѿ�����ϩ������������е�K+�����ý�MnO4������ϩ���У�����ϩ����MnO4���Ӵ����ᣬ��������Ч���� �����Ƿ��Ӿ��壬���Ӽ���������С���۷е�Զ���ڳ��¡� 12 ��-0.5a,0.5a,a�� 64��1021/(a NA)
��������
��a.��̬����Ӻ�������Ų�Ϊ1S2�����Ժ���������ߵĵ��������ܲ����ΪK��
b.��Ϊ���õ��Ӷ�����ԭ���ṩ��������ӹ��ã�����������λ����
�ڸ���Li+�İ뾶��K+�İ뾶С���ش�
����ˮ�����У���ԭ��2s��2px��2py��2pz 4��ԭ�ӹ��ͨ��sp3�ӻ��γ�4���ӻ����������ˮ�����������ӻ�����Ŀռ乹��Ϊ�������幹�ͣ�����������2��δ���õĵ��Ӷԣ���֮Ϊ�µ��Ӷ���ռ��������sp3�ӻ�����С��µ��Ӷ���ռ�õ��ӻ���������ƱȽ��ܼ����Գɼ����Ӷ���ռ���ӻ���������Ƴ��ѹ�������ã���������O-H����нDZ�ѹ������104��45�䣬�����������������ӻ���109��28�䣻
ii. ����������ԭ����֪�����ѿ�����ϩ������������е�K+�����ý�MnO4������ϩ���У�����ϩ����MnO4���Ӵ����ᣬ��������Ч����
(2)�ټ������ڷ��Ӿ��壬������ڷ��Ӽ����������з�����
�ڸ��ݾ������Կ���������ľ����ṹΪ�������������Լ������λ��Ϊ12��
��A������̼ԭ�ӵ��������Ϊ(0��0��0)����B���ӵ�̼ԭ�ӵ��������Ϊ��-0.5a,0.5a,a��
����������м�����ӵ��������ٳ��Ծ��������
��a.��̬����Ӻ�������Ų�Ϊ1S2�����Ժ���������ߵĵ��������ܲ����ΪK��
��ȷ�𰸣�K��
b.��Ϊ���õ��Ӷ�����ԭ���ṩ��������ӹ��ã�����������λ����
��ȷ�𰸣�C��
�ڸ���Li+�İ뾶��K+�İ뾶С���ش�
��ȷ�𰸣�Li+�뾶��Y�Ŀ�ǻС�ö࣬�������ǻ����ԭ�ӵŵ��Ӷ������γ��ȶ��ṹ��
����ˮ�����У���ԭ��2s��2px��2py��2pz4��ԭ�ӹ��ͨ��sp3�ӻ��γ�4���ӻ����������ˮ�����������ӻ�����Ŀռ乹��Ϊ�������幹�ͣ�����������2��δ���õĵ��Ӷԣ���֮Ϊ�µ��Ӷ���ռ��������sp3�ӻ�����С��µ��Ӷ���ռ�õ��ӻ���������ƱȽ��ܼ����Գɼ����Ӷ���ռ���ӻ���������ų��ѹ�������ã���������O-H����нDZ�ѹ������104��45�䣬���������������������е�109��28�䡣
��ȷ�𰸣��������� ��
ii. ����������ԭ����֪�����ѿ�����ϩ������������е�K+�����ý�MnO4������ϩ���У�����ϩ����MnO4���Ӵ����ᣬ��������Ч����
��ȷ�𰸣����ѿ�����ϩ������������е�K+�����ý�MnO4������ϩ���У�����ϩ����MnO4���Ӵ����ᣬ��������Ч����
(2)�ټ������ڷ��Ӿ��壬�����Ƿ��Ӽ����������з�����
��ȷ�𰸣������Ƿ��Ӿ��壬���Ӽ���������С���۷е�Զ���ڳ��¡�
�ڸ��ݾ������Կ���������ľ����ṹΪ�������������Լ������λ��Ϊ12��
��ȷ�𰸣�12
��A������̼ԭ�ӵ��������Ϊ(0��0��0)����B���ӵ�̼ԭ�ӵ��������Ϊ��-0.5a,0.5a,a��
��ȷ�𰸣���-0.5a,0.5a,a��
����������м�����ӵ��������ٳ��Ծ��������
��1�������к��м��������Ϊ8��1/8+6��1/2=4��������Ϊm��CH4��=![]() =64/NAg����2���������V=��a��10-7cm��3=a3��10-21cm3 �����ݣ�1����2���õ��ܶ�= m��CH4��/V=(64/NAg)/��a3��10-21cm3��=64��1021/(a3NA);
=64/NAg����2���������V=��a��10-7cm��3=a3��10-21cm3 �����ݣ�1����2���õ��ܶ�= m��CH4��/V=(64/NAg)/��a3��10-21cm3��=64��1021/(a3NA);
��ȷ�𰸣�64��1021/(a3NA)��







