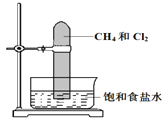
题目内容
【题目】亚铁氰化钠晶体[Na4Fe(CN)6·10H2O,M=484g·mol-1]可用作食盐抗结剂。请回答
(1)向Na4Fe(CN)6溶液中滴入FeCl3溶液,出现蓝色沉淀,其离子方程式为______________。
(2)已知:Ag4Fe(CN)6为白色难溶物, Cu2Fe(CN)6为红棕色难溶物。市售亚铁氰化钠常含有Cl-杂质,选用下列试剂设计实验方案进行Cl-检验。
试剂:稀HNO3、稀H2SO4、AgNO3溶液、CuSO4溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③_______ | ④______ |
⑤静置,_____ | ⑥出现白色浑浊 |
(3)利用铈量法测定亚铁氰化钠晶体纯度的实验如下:称取1.2100g样品,置于500mL仪器a中,加入25mL除氧蒸馏水,加入25mL浓硫酸酸化并冷却,滴加3滴橘红色邻二氮菲(phen)—FeSO4指示剂,用0.1000mo1·L-1的Ce(SO4)2标准溶液滴定,发生反应:Ce4++[Fe(CN)6]4-=Ce3++[Fe(CN)6]3-。当溶液从橘红色变为淡黄色,即为终点。平行滴定3次,标准溶液的平均用量为24.50mL。
①仪器a的名称为_________________。
②“浓硫酸酸化”的实验操作为______________________
③样品纯度为__________________%
【答案】4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓ 加入过量CuSO4溶液 出现红棕色沉淀 取上层清液,加入过量稀硝酸酸化,然后加入AgNO3溶液 锥形瓶 沿瓶壁缓缓加入浓硫酸,并不断搅拌 98
【解析】
(2)本实验的目的是检验Clˉ,一般通过氯离子和银离子可以生成不溶于酸的白色沉淀来检验氯离子,但根据题目信息可知Ag4Fe(CN)6为白色难溶物,会干扰氯离子的检验,所以需要先将[Fe(CN)6]4ˉ除去,根据提供的试剂,可以用过量的硫酸铜将[Fe(CN)6]4ˉ沉淀除去,然后取上层清液检验是否含有氯离子。
(1)该蓝色沉淀应为Fe4[Fe(CN)6]3,根据电荷守恒可得离子方程式为4Fe3++3[Fe(CN)6]4ˉ=Fe4[Fe(CN)6]3↓;
(2)根据分析可知需要先用过量硫酸铜将[Fe(CN)6]4ˉ除去,所以步骤③为加入过量CuSO4溶液;现象④为出现红棕色沉淀;之后取上层清液用酸化的硝酸银检验氯离子,所以步骤⑤为静置,取上层清液,加入过量稀硝酸酸化,然后加入AgNO3溶液;
(3)①滴定时待测液放在锥形瓶中,所以仪器a为锥形瓶;
②浓硫酸稀释时会放热,为了防止暴沸,浓硫酸酸化时需要沿瓶壁缓缓加入浓硫酸,并不断搅拌;
③标准溶液的平均用量为24.50mL,浓度为0.1000mo1·L-1,根据发生的离子方程式可知n{[Fe(CN)6]4-}=n(Ce4+)=0.0245L×0.1000mo1·L-1=0.00245mol,所以样品的纯度为![]() =98%。
=98%。

 轻松暑假总复习系列答案
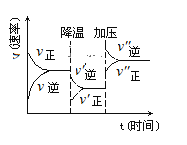
轻松暑假总复习系列答案【题目】(I)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e_______对反应速率的影响 |
② | 25 | 粗颗粒 | a______ | |
③ | b_______ | 粗颗粒 | 2.00 | |
④ | c________ | 细颗粒 | d______ |
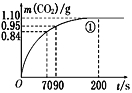
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在0~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1 | 0.6mol·L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(3)表中V1=_______mL,V2=_______mL。
(4)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。