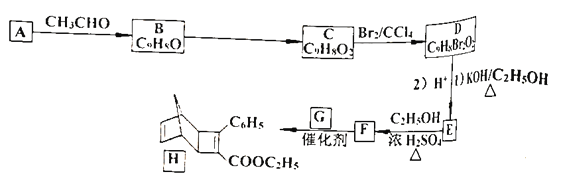
题目内容
【题目】已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)=2NH3(g) ΔH=-92.0 kJ/mol,将1 mol N2和3 mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时向该容器中充入2 mol NH3,反应达到平衡时的热量变化是( )
A.吸收18.4 kJ热量B.吸收73.6 kJ热量
C.放出18.4 kJ热量D.放出73.6 kJ热量
【答案】B
【解析】
![]()
起始: 1mol 3mol 0
转化: 0.2mol 0.6mol 0.4mol
平衡: 0.8mol 2.4mol 0.4mol
放出热量为![]() ,
,
保持恒温恒压,将![]()
![]() 和
和![]()
![]() 充入一密闭容器中与起始时在该容器中充入
充入一密闭容器中与起始时在该容器中充入![]()
![]() ,为等效平衡状态,平衡时两种不同的途径平衡状态相同,各物质的含量、物质的量等都相同,则
,为等效平衡状态,平衡时两种不同的途径平衡状态相同,各物质的含量、物质的量等都相同,则
![]() ;
;![]()
起始:2mol 0 0
转化:1.6mol 0.8mol 2.4mol
平衡:0.4mol 0.8mol 2.4mol
吸收热量为:![]() ,
,
所以B选项是正确的.

练习册系列答案
相关题目