题目内容
【题目】NA代表阿伏加德罗常数,以下说法正确的是
A. 标准状况下,11.2LH2O含H2O分子0.5NA
B. 1molFe与1molCl2充分反应转移电子3NA
C. 常温常压下,32g O2与O3的混合气中含氧原子2NA
D. 将0.1molFeCl3滴入沸水所形成胶体中含有氢氧化铁胶体粒子数目为 0.1 NA
【答案】C
【解析】
标准状况下, H2O是液体;Fe与Cl2反应生成FeCl3,1molFe与1molCl2充分反应,氯气不足,生成 mol FeCl3;32gO2和O3的混合气体中氧元素的质量为32g,氧原子的物质的量为:32g÷16g/mol=2mol;氢氧化铁胶体粒子是氢氧化铁的聚集体。
mol FeCl3;32gO2和O3的混合气体中氧元素的质量为32g,氧原子的物质的量为:32g÷16g/mol=2mol;氢氧化铁胶体粒子是氢氧化铁的聚集体。
标准状况下, H2O是液体,11.2LH2O含H2O的物质的量不是0.5mol,故A错误;1molFe与1molCl2充分反应,氯气不足,生成 mol FeCl3,转移电子转移电子2NA,故B错误;32gO2和O3的混合气体中氧元素的质量为32g,氧原子的物质的量为:32g÷16g/mol=2mol,含氧原子2NA,故C正确;氢氧化铁胶体粒子是氢氧化铁的聚集体,将0.1molFeCl3滴入沸水所形成胶体中含有氢氧化铁胶体粒子数目小于 0.1 NA,故D错误。
mol FeCl3,转移电子转移电子2NA,故B错误;32gO2和O3的混合气体中氧元素的质量为32g,氧原子的物质的量为:32g÷16g/mol=2mol,含氧原子2NA,故C正确;氢氧化铁胶体粒子是氢氧化铁的聚集体,将0.1molFeCl3滴入沸水所形成胶体中含有氢氧化铁胶体粒子数目小于 0.1 NA,故D错误。

【题目】Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _________℃。
Ⅱ、向一体积不变的密闭容器中充入2 mol A、0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g) ![]() 3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
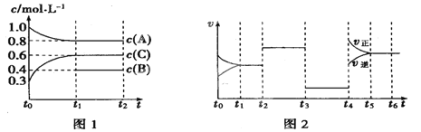
(1)若t1=15 min,则t0~t1阶段以C的浓度变化表示的反应速率V(C)=_____。
(2)t3时改变的条件为___________,B的起始物质的量为_______。
(3)t4~t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式___________________。
【题目】下表是中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题。
| IA | 0 | |||||||
1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
2 | ② | ③ | Ne | ||||||
3 | ④ | ⑤ | Al | S | ⑥ | ||||
(1)②表示的元素名称是____________;
(2)⑥的原子结构示意图是______________;
(3)由①和③两种元素组成的化合物的电子式是___________;
(4)②和③中,最高价氧化物对应的水化物酸性最强的酸的化学式是_____________。