题目内容
【题目】下列说法正确的是( )
A. 在粗硅的制取中发生2C+SiO2![]() 2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B. 盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2![]() Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
【答案】C
【解析】
A、依据元素周期律,硅的还原性大于碳,上述反应能发生是因为产物中有CO气体生成,使平衡向右移动,故A错误;
B、磨口玻璃塞中玻璃成分二氧化硅能和氢氧化钠反应,生成具有粘性的硅酸钠,造成玻璃塞和瓶体粘在一起,不便于打开,所以盛放氢氧化钠溶液时,不可以用玻璃瓶塞,故B错误;
C、二氧化硅难溶于水,所以无法用二氧化硅和水直接反应制得,用SiO2制取硅酸,先使二氧化硅与氢氧化钠溶液反应,SiO2+2NaOH=Na2SiO3+H2O,因碳酸酸性强于硅酸且硅酸溶解度较小的沉淀,所以通入CO2,发生Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,制得硅酸,故C正确;
D、反应不是在水溶液中进行的,且产物中有气体生成,与酸性强弱无关,一般在溶液中强酸可制得弱酸,即硅酸钠溶液中通入CO2,制得硅酸说明碳酸酸性强于硅酸,故D错误。
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】已知反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为____。
(2)上述反应中的a_______0(填“大于”“小于”或“等于”)。
(3)700℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有____(填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900℃ D.使用合适的催化剂
【题目】在2 L密闭容器内,800 ℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
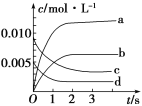
(2)如图,表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=________。
(3)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂