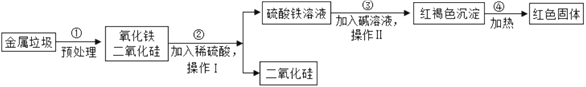
题目内容
【题目】钠和铝均是重要的金属。
(1) 铝的原子结构示意图是___________________。
(2) 铝与NaOH溶液反应的离子方程式为______________________________;
(3)同温同压下,在体积和浓度均为100 mL 0.2 mol·L-1的盐酸及NaOH溶液中各加入等质量的Al, 产生气体的体积之比为5∶6,则所加Al的质量为______________。
(4) 过氧化钠可做呼吸面具的供氧剂,其中Na2O2与CO2反应的化学方程式为________________。
【答案】 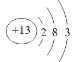 2Al + 2OH- + 2H2O ═ 2AlO2- + 3H2↑ 0.216 g 2Na2O2 + 2CO2 ═ 2Na2CO3 + O2
2Al + 2OH- + 2H2O ═ 2AlO2- + 3H2↑ 0.216 g 2Na2O2 + 2CO2 ═ 2Na2CO3 + O2
【解析】本题主要考查钠和铝的性质。
(1)铝的原子结构示意图是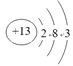 。
。
(2)铝与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)a.2Al+6HCl![]() 2AlCl3+3H2↑,b.2Al+2NaOH+2H2O
2AlCl3+3H2↑,b.2Al+2NaOH+2H2O![]() 2NaAlO2+3H2↑。HCl和NaOH的物质的量均为0.2mol。同温同压下氢气的物质的量之比等于体积之比为5∶6。若HCl和NaOH完全反应,则产生氢气的物质的量之比为1:3;若铝完全反应,则产生氢气的物质的量之比为1:1。实际产生氢气的物质的量之比为5:6,说明反应a剩余铝,HCl完全消耗,反应b剩余氢氧化钠,铝完全消耗。根据反应a和反应b产生氢气的物质的量之比为5:6,得到反应a中HCl与反应b中铝的关系为10HCl~4Al,因此,所加Al的物质的量为0.08mol,所加Al的质量为0.08mol×27g/mol=0.216g。
2NaAlO2+3H2↑。HCl和NaOH的物质的量均为0.2mol。同温同压下氢气的物质的量之比等于体积之比为5∶6。若HCl和NaOH完全反应,则产生氢气的物质的量之比为1:3;若铝完全反应,则产生氢气的物质的量之比为1:1。实际产生氢气的物质的量之比为5:6,说明反应a剩余铝,HCl完全消耗,反应b剩余氢氧化钠,铝完全消耗。根据反应a和反应b产生氢气的物质的量之比为5:6,得到反应a中HCl与反应b中铝的关系为10HCl~4Al,因此,所加Al的物质的量为0.08mol,所加Al的质量为0.08mol×27g/mol=0.216g。
(4)过氧化钠可做呼吸面具的供氧剂,其中Na2O2与CO2反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2。

 阅读快车系列答案
阅读快车系列答案