题目内容
13. 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑;
CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C;
CaCN2+2H2O=NH2CN+Ca(OH)2
NH2CN与水反应生成尿素[CO(NH2)2],再由尿素合成三聚氰胺.
(1)写出与Ca在同一周期的Cu原子的基态电子排布式[Ar]3d104s1.
(2)写出CaC2中阴离子C22-的一种等电子体的化学式N2、CO、CN-等任写一个.
(3)1mol 尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为1:7.
(4)三聚氰胺俗称“蛋白精”,其结构为
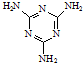 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.(5)CaO晶胞如图所示,CaO晶体中与O2-距离最近的O2-的个数为12.CaO晶体的熔点比NaCl晶体的熔点高的主要原因是CaO晶体中Ca2+、O2-的电荷数比NaCl晶体中Na+、Cl-大,CaO晶体的晶格能大.
分析 (1)Cu原子核外电子数为29,根据能量最低原理书写核外电子排布式;
(2)原子总数相同、价电子总数(或电子总数)相同的微粒互为等电子体;
(3)CO(NH2)2中C原子与氧原子之间形成C=O双键,C原子与N原子之间形成2个C-N单键,N原子与H原子之间共形成4个N-H键,单键是σ键,双键中含有1个σ键和1个π键;
(4)环中N原子形成2个σ键,含有1对孤电子对,杂化轨道数目为3,氨基中N原子形成3个σ键,含有1对孤电子对,杂化轨道数目为4;
(5)以面心O2-研究,与之最近的O2-位于面心和顶角;电荷越大、半径越小,晶格能越大,离子晶体的熔点越高,电荷为主要影响原因.
解答 解:(1)Cu原子核外电子数为29,核外电子排布式为[Ar]3d104s1,故答案为:[Ar]3d104s1;
(2)原子总数相同、价电子总数(或电子总数)相同的微粒互为等电子体,与C22-的一种等电子体的化学式为:N2、CO、CN-等,故答案为:N2、CO、CN-等任写一个;
(3)CO(NH2)2中C原子与氧原子之间形成C=O双键,C原子与N原子之间形成2个C-N单键,N原子与H原子之间共形成4个N-H键,单键是σ键,双键中含有1个σ键和1个π键,所以1mol 尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为1:7,故答案为:1:7;
(4)环中N原子形成2个σ键,含有1对孤电子对,杂化轨道数目为3,采取sp2杂化,氨基中N原子形成3个σ键,含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,故答案为:sp2、sp3;
(5)以面心O2-研究,与之最近的O2-位于面心和顶角,故与之最近的O2-共有4×3=12;
CaO晶体的熔点比NaCl晶体的熔点高的主要原因是:CaO晶体中Ca2+、O2-的电荷数比NaCl晶体中Na+、Cl-大,CaO晶体的晶格能大,
故答案为:12;CaO晶体中Ca2+、O2-的电荷数比NaCl晶体中Na+、Cl-大,CaO晶体的晶格能大.
点评 本题是对物质结构的考查,涉及核外电子排布、化学键、杂化方式判断、晶胞计算、离子晶体熔沸点比较等,是对学生综合能力的考查,难度中等.

①固体热稳定性:Na2CO3>CaCO3>NaHCO3
②微粒半径:F->Na+>Mg2+>S2-
③燃烧热:S(气体)>S(液体)>S(固体)
④物质的熔点:植物油>动物油.
| A. | ①③④ | B. | ①③ | C. | ①②③④ | D. | ②③④ |
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键键能 Ⅱ.H-I键键能小于H-Cl键键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HI比HCl不稳定 ③HI沸点比HCl高 ④HI沸点比HCl低 |
| A. | Ⅰ、① | B. | Ⅳ、② | C. | Ⅲ、③ | D. | Ⅱ、④ |
| A. | 若n=4,则X是第四周期元素 | |
| B. | 若n=3,则Z可能等于25 | |
| C. | 若X是第四周期元素,则具有“ns2np6nd5”排布的原子一定只有2种 | |
| D. | 若n=4,则X的基态原子一定有10个s电子 |
 有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )| A. | X、Y一定互为同系物 | B. | X、Y的通式一定不同 | ||
| C. | X、Y可能互为同分异构体 | D. | X、Y一定互为同分异构体 |
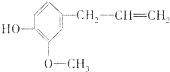 ,它在一定条件下可能发生的反应( )
,它在一定条件下可能发生的反应( )①加成;②水解;③取代;④氧化;⑤中和;⑥消去;⑦还原;⑧加聚.
| A. | ①③④⑤⑥⑦⑧ | B. | ①③④⑤⑦⑧ | C. | ①③⑤⑥⑦ | D. | ②③④⑤⑥ |