题目内容
【题目】据图回答下列问题:
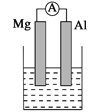
Ⅰ.(1)若烧杯中溶液为稀硫酸,则观察到的现象是______。 负极反应式为:__________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为_____(填Mg 或 Al), 总反应化学方程式_______。
Ⅱ、由 Al、Cu、浓硝酸组成原电池,其正极的电极反应式___________________________。
Ⅲ.中国科学院长春应用化学研究所在燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲烷燃料电池的工作原理如下图所示。
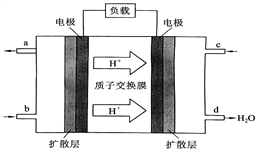
(1)该电池工作时,b 通入的物质为_____, c 通入的物质为___________________。
(2)该电池正极的电极反应式为:___________________。
(3)工作一段时间后,当 3.2 g 甲烷完全反应生成 CO2 时,有_______个电子转移。
【答案】 Mg 逐渐溶解;Al 片上有气泡冒出;指针偏转 Mg-2e-=Mg2+ Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ NO3-+e-+2H+=NO2↑+H2O CH3OH O2 或空气 O2+4e-+4H+=2H2O 1.6NA
【解析】试题分析:Ⅰ(1)若烧杯中溶液为稀硫酸,镁、铝都能与稀硫酸反应,而Mg更活泼为负极,AL是正极,镁是负极。
(2)若烧杯中溶液为氢氧化钠溶液,铝与氢氧化钠反应放出氢气,铝是负极;镁与氢氧化钠溶液不反应,镁是正极;
Ⅱ、由 Al、Cu、浓硝酸组成原电池,铝在浓硝酸中钝化,铜与浓硝酸反应;
Ⅲ.根据氢离子移动方向,右侧电极是正极,左侧电极是负极。
解析:Ⅰ.(1)若烧杯中溶液为稀硫酸,两者都能与稀硫酸反应,而Mg更活泼为负极,AL是正极,负极:Mg-2e- =Mg2+ 镁片溶解; 正极:2H+ +2e- =H2 ↑,Al片上有气泡冒出 ,电流计指针偏转。
(2) 若烧杯中溶液为氢氧化钠溶液,只有AL能与NaOH反应,所以Al是负极,Mg是正极;总反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
II.由Al、Cu、浓硝酸组成原电池,铝在浓硝酸中钝化,铜与浓硝酸反应,正极是Al、负极是铜,总反应是Cu+4HNO3 (浓)=Cu(NO3)2 +2NO2↑+2H2O; 负极:Cu - 2e- =Cu2+;正极:![]() ;
;
Ⅲ.由图可知氢离子向右侧移动,所以左侧为负极、右侧为正极。b口通入CH4,C口通入O2或空气,正极反应式:O2+4e-+4H+=2H2O;根据总反应:CH4+2O2 =CO2 +2H2O,1mol甲烷参加反应,转移电子8mol,当 3.2 g 甲烷即0.2mol参加反应,电子转移1.6mol,即1.6NA个电子转移。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案