题目内容
5.某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质.己知:SO2的沸点为-10℃、SO2的沸点为44.8℃.Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物.

(1)在加药品之前必须进行的操作是检查装置气密性.
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→d→e→f→g→b→c.
(3)该实验观察到装置甲中固体变为红棕色,装置丙中有无色液体产生,装置丁中溶液变成无色,若要检验固体产物中的金属阳离子所需化学试剂为盐酸或硫酸和KSCN溶液.根据以上实验推测FeSO4分解的化学方程式为2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验l:将稀盐酸和NaOH 溶液分别滴入品红水溶液中.观察到前者溶液颜色变钱,但未能完全褪色,后者溶液颜色几乎不变.
实验2:在滴有稀盐酸和NaOH 溶液的两份品红水溶液中分别通入SO2.观察到前者溶液逐渐褪色,后者溶液很快褪色.
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者浴液褪色很慢.
(l)由实验l可推测品红水溶液呈碱 性.
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是SO32- (填化学式).
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象品红的无水乙醇溶液不褪色
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因Na2SO3溶液中的c(SO32-)大,加热后水解程度增大,但仍无法除尽.
分析 I.甲装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用(丙装置)冰水混合物使三氧化硫液化,丁中装有品红溶液,检验二氧化硫,二氧化硫有毒,会污染空气,故用(乙装置)氢氧化钠溶液吸收.
(1)连接好装置后必须进行检查装置气密性,确保装置气密性良好,避免SO3和SO2泄漏污染空气以及影响实验的进行;
(2)甲装置为FeSO4在高温下分解装置,乙装置为吸收尾气装置,丙装置冰水混合物使三氧化硫液化,丁装置用品红溶液检验二氧化硫,据此分析选择连接口;
(3)甲中固体变为红棕色,说明有Fe2O3生成;若观察到装置丙中有无色液体产生为水,装置丁中溶液变成无色有二氧化硫产生,FeSO4分解生成Fe2O3、SO3和SO2.
Ⅱ.(1)品红在碱性溶液中颜色不变,在酸性溶液中褪色,为酸和碱的中和反应,即品红显示碱性;
(2)对照实验2、3,分析可知SO32-使品红水溶液褪色;
(3)乙醇为非电解质,乙醇为有机物与品红互溶,将SO2通入品红的无水乙醇溶液,品红的无水乙醇溶液不褪色;
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,Na2SO3溶液中的c(SO32-)大,加热后水解程度增大,但仍无法除尽SO32-.
解答 解:I.(1)该实验装置中连接了多个仪器,且SO3和SO2是有毒气体,为避免SO3和SO2泄漏,污染空气、浪费试剂,且保证实验的顺利进行,所以在实验前需要检验装置气密性,
故答案为:检查装置气密性;
(2)甲装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即a和d相连,检验二氧化硫用品红溶液,丁中装有品红溶液,即e和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和b相连,所以按气流方向连接各仪器连接顺序为a→d→e→f→g→b→c,
故答案为:d→e→f→g→b→c;
(3)甲中固体变为红棕色,说明有Fe2O3生成,检验固体产物中的金属阳离子所需化学试剂为盐酸或硫酸和KSCN溶液;若观察到装置丙中有无色液体产生为水,装置丁中溶液变成无色有二氧化硫产生,FeSO4分解生成Fe2O3、SO3和SO2,反应的方程式为:2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑,
故答案为:盐酸或硫酸和KSCN溶液;2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
II.(1)将稀盐酸和NaOH溶液分别滴入品红水溶液中.观察到前者溶液颜色变浅,可能品红显示碱性,为酸和碱的中和反应,在酸性溶液中褪色,品红在碱性溶液中颜色不变,
故答案为:碱;
(2)实验2:二氧化硫溶于水显酸性,电离出氢离子、亚硫酸根离子、亚硫酸氢根离子,在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2,观察到前者溶液逐渐褪色,可能品红显示碱性,为酸和碱的中和反应,也可能为亚硫酸根离子、亚硫酸氢根离子使品红水溶液褪色,
后者溶液很快褪色,可能为二氧化硫和碱反应,2NaOH+SO2═Na2SO3+H2O,NaOH溶液碱性减弱,品红显示碱性,二氧化硫与之反应,溶液很快褪色,也可能为亚硫酸根离子使品红水溶液褪色.
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,为亚硫酸根离子的作用,后者溶液褪色很慢,说明不是钠离子作用,对照实验2:SO32-使品红水溶液褪色,
故答案为:SO32-;
(3)乙醇为非电解质,乙醇为有机物与品红互溶,品红的无水乙醇溶液无离子存在,将SO2通入品红的无水乙醇溶液,试预测可能出现的现象品红的无水乙醇溶液不褪色,
故答案为:品红的无水乙醇溶液不褪色;
(4)由实验2、3可推知,SO32-使品红水溶液褪色,Na2SO3溶液中的c(SO32-)大,加热后水解程度增大,但仍无法除尽SO32-,所以加热溶有Na2SO3的品红水溶液,发现不能恢复红色,
故答案为:Na2SO3溶液中的c(SO32-)大,加热后水解程度增大,但仍无法除尽.
点评 本题考查验证分解FeSO4生成的气态产物实验、实验方案设计评价,题目难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意硫元素化合物知识的积累和灵活运用,探究SO2使品红溶液褪色的原理为该题的难点.

| A. | 0.5 mol雄黄(As4S4,结构如图) 含有4NA个As-S键 含有4NA个As-S键 | |
| B. | 3.9 g Na2S和3.9 g Na2O2中含有的阴离子数目均为0.1NA | |
| C. | 1.8 g ${\;}_{8}^{18}$O2分子与1.8 g ${\;}_{8}^{18}$O3分子中含有的中子数目不相同 | |
| D. | 氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |
| A. | 把氢氧化钠固体放在滤纸上称量 | |
| B. | 制取氯气时,将二氧化锰与浓盐酸加强热,用向下排气法收集氯气 | |
| C. | 配制0.1mol/L H2SO4溶液时,将量取的浓H2SO4放入容量瓶中稀释 | |
| D. | 做焰色反应时,每次实验前一定要用稀盐酸洗净铂丝,并在火焰上灼烧到没有颜色 |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ | ⑩ |
(2)①~⑩元素中,最高价氧化物对应的水化物呈两性的元素是Al(填元素符号),该最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
(3)①~⑩元素中,最高价氧化物对应的水化物的酸性最强的是HClO4(填化学式),碱性最强的是KOH(填化学式).
(4)⑤、⑥、⑧、⑨所形成的简单离子的半径由大到小的顺序是S2->Cl->K+>Ca2+.(填离子符号)

| A. | 属于烃的衍生物 | B. | 烃基上的一氯取代物有9种 | ||
| C. | 与乙醇互为同系物 | D. | 能与乙酸发生酯化反应 |
| A. | W在自然界只有一种核素 | |
| B. | 半径大小:X+<Y3+<Z- | |
| C. | Y与Z形成的化合物的水溶液呈弱酸性 | |
| D. | X的最高价氧化物对应的水化物为弱碱 |
| A. |  制备Cl2 | B. | 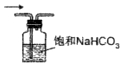 去除杂质 | C. |  干燥Cl2 | D. |  回收固体MnO2 |
| A. | X、Y、Z 一定位于同一周期 | |
| B. | X与Y形成的化合物中各原子不一定达到8电子稳定结构 | |
| C. | Y、Z的最高价氧化物对应水化物之间一定能相互反应 | |
| D. | W与X、Y形成的化合物的稳定性一定是前者大于后者 |