题目内容
常温下,取0.1 mol·L-1HY溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法不正确的是( )
| A.c(Na+)=c(Y-)+c(HY) |
| B.c(OH-)=c(H+)+c(HY) |
| C.c(Y-)>c(Na+)>c(OH-)>c(H+) |
| D.c(Na+)+c(H+)=c(OH-)+c(Y-) |
C
解析试题分析:A、根据物料守恒,正确;B、根据质子守恒,正确;C、两者恰好反应得到NaY溶液,根据pH = 9,推出NaY是强碱弱酸盐,Y-发生水解反应,则c(Na+)> c(Y-),错误;D、根据电荷守恒,正确。
考点:考查电解质溶液浓度大小关系,涉及三大守恒。

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
下列有关溶液中离子浓度的关系,不正确的是
| A.NaHCO3溶液中存在:c(OH-)=c(H2CO3)+c(H+) |
| B.常温下,pH=3的盐酸和pH=ll的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-) |
| C.0.2 mol/LNH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后,溶液中:c(NH4+)>c(Na+) |
| D.0.2 mol/L 的 CH3COOH 溶液中c(H+)小于0.1 mol/L 的 CH3COOH 中c(H+)的两倍 |
常温下,等物质的量浓度的三种盐溶液NaX、NaY、NaZ,其溶液的pH依次为7、8、9,下列有关说法正确的是( )
| A.HX、HY、HZ三种酸的酸性由强到弱的顺序为HZ>HY>HX |
| B.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ |
| C.X-、Y-、Z-三种酸根均能水解,且水解程度Z->Y->X- |
| D.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(Z-)>c(Y-)>c(X-) |
下列叙述正确的是
| A.浓度均为0.1mol?L—1的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: c(CH3COOH)+c(CH3COO—)=0.2mol?L-1 |
| B.0.1mol?L-1NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2(CO32-) |
| C.0.2mol?L-1HCl溶液与等体积0.1mol?L-1NaOH溶液混合后,溶液的pH=1 |
| D.0.1mol?L-1氨水中滴入0.1mol?L-1盐酸至溶液呈中性时,混合溶液中:c(NH4+)=c(Cl—) |
25℃,加水稀释10mLpH=11的氨水,下列判断正确的是
| A.原氨水的浓度=10-3mol /L |
| B.氨水的电离程度增大,溶液中所有离子的浓度均减小 |
C.溶液中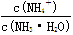 的增大 的增大 |
| D.再加入10mLpH=3的盐酸,混合液pH=7 |
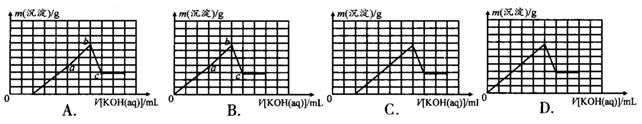
室温下,向20.00mL 1.000mol·L-1氨水中滴入1.000mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法错误的是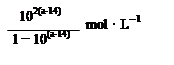
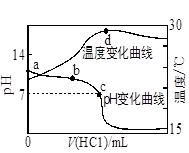
| A.室温下,a点的氨水电离常数为 |
| B.将此氨水稀释,溶液的导电能力减弱 |
| C.c点时消耗盐酸体积V(HCl)<20mL |
| D.a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
 L-1的二元酸H2A溶液的pH=4.0则下列说法中正确的是
L-1的二元酸H2A溶液的pH=4.0则下列说法中正确的是