题目内容
下列叙述正确的是
| A.浓度均为0.1mol?L—1的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: c(CH3COOH)+c(CH3COO—)=0.2mol?L-1 |
| B.0.1mol?L-1NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2(CO32-) |
| C.0.2mol?L-1HCl溶液与等体积0.1mol?L-1NaOH溶液混合后,溶液的pH=1 |
| D.0.1mol?L-1氨水中滴入0.1mol?L-1盐酸至溶液呈中性时,混合溶液中:c(NH4+)=c(Cl—) |
D
解析试题分析:A、假设体积都为V,溶液混合后体积变为2V,根据物料守恒n(CH3COOH)+n(CH3COO-)=0.2V,所以浓度应该为0.1mol/L;B、式中都为溶质中的物质,所以为物料守恒,CO32-前的系数应为1;C、两溶液混合后H+的浓度为0.05mol/L,所以PH不等于1;D、混合溶液里离子只有NH4+、H+、Cl-、OH-,而此时溶液显中性c(OH-)=c(H+),根据电荷守恒c(NH4+)=c(Cl-)
考点:本题考查电解质溶液;涉及离子浓度大小比较,守恒关系应用等。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
下列电解质溶液的有关叙述正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCI与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol/L盐酸③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
| A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2 |
| D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于 2.2×10-6 mol·L-1 |
25℃时,下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-) >c(H2CO3) |
| D.pH=11氨水与pH=3盐酸等体积混合c(Cl-)>c(NH4+)>c(OH-) =c(H+) |
常温下,取0.1 mol·L-1HY溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法不正确的是( )
| A.c(Na+)=c(Y-)+c(HY) |
| B.c(OH-)=c(H+)+c(HY) |
| C.c(Y-)>c(Na+)>c(OH-)>c(H+) |
| D.c(Na+)+c(H+)=c(OH-)+c(Y-) |
Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n(SO32—): n(HSO3—)变化的关系如下表:
| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+)> c (OH—)
B.Na2SO3溶液中c(Na+)> c (SO32—)> c (HSO3—)> c (OH—)> c(H+)
C.当吸收液呈中性时,c(Na+)>c (SO32—)> c (HSO3—)> c (OH—) = c(H+)
D.当吸收液呈中性时,c(Na+)=c (HSO3—)+2c (SO32—)
下列叙述正确的是
| A.将pH=2的盐酸和pH=2的醋酸等体积混合,混合后溶液的pH=2 |
| B.HA-比HB-更难电离,则NaHA溶液的pH一定比NaHB溶液的大 |
| C.在饱和氨水中加入同浓度的氨水,平衡正向移动 |
| D.某温度下,Ba(OH)2溶液中,Kw=10-12,pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液的pH=7 |
常温下,浓度均为0.1000 mol ? L -1的三种一元酸HX、HY、HZ,分别用0. 1000 mol ? L-1的NaOH溶液进行滴定,滴定曲线如图所示。下列有关叙述正确的是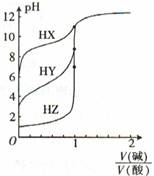
| A.NaOH溶液与三种酸的反应均是吸热反应 |
| B.酸性强弱:HX>HY>HZ |
| C.滴定酸HY可用酚酞作指示剂 |
| D.滴定三种酸都可用甲基橙作指示剂 |
 mol?L-1,则此溶液一定呈中性
mol?L-1,则此溶液一定呈中性