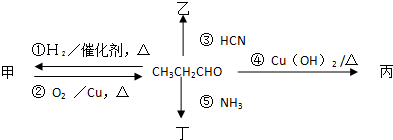
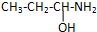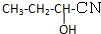题目内容
6.同温同压下,同体积的一氧化碳与乙烯(C2H4)相比较,下列叙述不正确的是( )| A. | 质量比和密度比均为1:1 | |
| B. | 质子数之比为7:8 | |
| C. | 二者所含原子数之比为1:2 | |
| D. | 二者完全燃烧产生二氧化碳的物质的量之比为1:2 |
分析 根据n=$\frac{V}{{V}_{m}}$可知,同温同压下,同体积的一氧化碳与乙烯(C2H4)的物质的量相等;一氧化碳和乙烯的相对分子质量相等,都是28,
A.根据ρ=$\frac{m}{V}$=$\frac{M}{{V}_{m}}$可知,密度与相对分子质量成正比;
B.一氧化碳分子含有14个质子、乙烯分子含有16个质子;
C.一氧化碳含有2个原子,乙烯分子含有6个原子;
D.根据碳元素质量守恒计算出完全燃烧生成二氧化碳的物质的量之比.
解答 解:根据n=$\frac{V}{{V}_{m}}$可知,同温同压下,同体积的一氧化碳与乙烯(C2H4)的物质的量相等,
A.由n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$可知,密度ρ=$\frac{m}{V}$=$\frac{M}{{V}_{m}}$,在相同条件下气体的密度之比等于相对分子质量之比,所以两种气体的密度之比等于28:28=1:1,故A正确;
B.一氧化碳分子中含有14个质子,乙烯分子中含有16个质子,二者物质的量相等,则含有质子数之比为:14:16=7:8,故B正确;
C.二者的物质的量相等,一氧化碳含有2个原子,乙烯含有6个原子,则二者含有原子数之比为:2:6=1:3,故C错误;
D.一氧化碳分子中含有1个C、乙烯分子中含有2个C,二者的物质的量相等,根据碳元素质量守恒,完全燃烧生成二氧化碳的物质的量之比为:1:2,故D正确;
故选C.
点评 本题考查阿伏加德罗定律及推论,题目难度中等,注意物质的量与质量、体积、密度、粒子数目的计算公式的运用,以及对阿伏加德罗定律及推论的理解和应用.

练习册系列答案
相关题目
16.化学与生活、社会密切相关,下列有关生活中化学常识的说法错误的是( )
| A. | 乙醇和乙酸是常用调味品的主要成分 | |
| B. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| D. | 制作航天服的聚酯类纤维环和光导纤维都是新型无机非金属材料 |
17.下列各化合物的命名不正确的是( )
| A. | 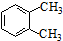 邻二甲苯 邻二甲苯 | B. | 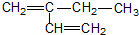 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | ||
| C. | 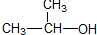 1-甲基乙醇 1-甲基乙醇 | D. |  3,4-二甲基己烷 3,4-二甲基己烷 |
1.浓硫酸有吸水性,常用作气体干燥剂,下列气体不能用浓硫酸干燥的是( )
| A. | Cl2 | B. | NH3 | C. | SO2 | D. | CH4 |
15.下列物质中,含有非极性共价键的离子化合物是( )
| A. | Na2O2 | B. | NaOH | C. | H2O2 | D. | NH3•H2O |