题目内容
15.下列物质中,含有非极性共价键的离子化合物是( )| A. | Na2O2 | B. | NaOH | C. | H2O2 | D. | NH3•H2O |
分析 活泼金属和活泼金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,为离子化合物,故A正确;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,为离子化合物,故B错误;
C.双氧水分子中H-O原子之间存在极性键、O-O原子之间存在非极性键,为共价化合物,故C错误;
D.一水合氨中N-H原子、O-H原子之间都只存在极性键,为共价化合物,故D错误;
故选A.
点评 本题考查离子化合物和共价化合物的判断,为高频考点,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,不能根据是否含有金属元素判断离子化合物,如铵盐中只含非金属元素但为离子化合物.

练习册系列答案
相关题目
5.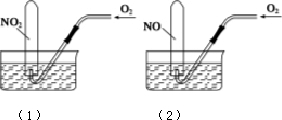 如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体.假设试管内的溶质不向水槽中扩散,则(1)和(2)两个试管内溶质物质的量浓度之比为( )
如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体.假设试管内的溶质不向水槽中扩散,则(1)和(2)两个试管内溶质物质的量浓度之比为( )
 如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体.假设试管内的溶质不向水槽中扩散,则(1)和(2)两个试管内溶质物质的量浓度之比为( )
如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体.假设试管内的溶质不向水槽中扩散,则(1)和(2)两个试管内溶质物质的量浓度之比为( )| A. | 1:1 | B. | 5:7 | ||
| C. | 7:5 | D. | 4:3 (1)(2) |
6.同温同压下,同体积的一氧化碳与乙烯(C2H4)相比较,下列叙述不正确的是( )
| A. | 质量比和密度比均为1:1 | |
| B. | 质子数之比为7:8 | |
| C. | 二者所含原子数之比为1:2 | |
| D. | 二者完全燃烧产生二氧化碳的物质的量之比为1:2 |
3.已知反应2A(g)+B(g)?3C(g)+4D(g),则下列反应速率最快的是( )
| A. | v(A)=1mol/(L•s) | B. | v(B)=1.5mol/(L•s) | C. | v(C)=2mol/(L•s) | D. | v(D)=3mol/(L•s) |
10.经测定,由乙醇、1-丙醇、庚烯和环己烷组成的混合物中氧的质量分数为8%,则此混合物中氢的质量分数为( )
| A. | 78% | B. | 22% | C. | 14% | D. | 13% |
20.苯酚在一定条件下能与氢气加成得到环己醇.下面关于这两种有机物的叙述中,错误的是( )
| A. | 都能溶于水,但溶解性都比乙醇的差 | |
| B. | 都能与金属钠反应放出氢气 | |
| C. | 苯酚是比碳酸更强的酸,环己醇则显中性 | |
| D. | 苯酚与FeCl3溶液作用显紫色,环乙醇加入FeCl3溶液中无明显现象 |
7.下列表达式错误的是( )
| A. | 碳-12原子表示为${\;}_{6}^{12}$C | |
| B. | 氮原子的L层电子的电子排布图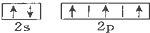 | |
| C. | 硫离子的核外电子排布式1s22s22p63s23p6 | |
| D. | NH4Cl的电子式为: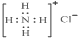 |
4.某元素原子核内质子数为m,中子数为n,则下列论断正确的是( )
| A. | 这种元素的相对原子质量为m+n | |
| B. | 若碳原子质量为wg,则此原子的质量为(m+n)wg | |
| C. | 不能由此确定该元素的相对原子质量 | |
| D. | 核内中子的总质量小于质子的总质量 |