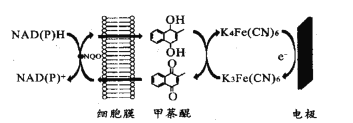
题目内容
【题目】25℃时,醋酸的电离常数为1.8×10-5。向20mL2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如图所示。下列说法正确的是( )
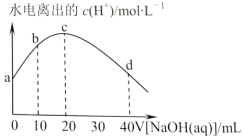
A.a点水电离出的c(H+)=6.0×10-3mol/L
B.b点c(CH3COOH)>c(Na+)>c(CH3COO-)
C.c点恰好完全反应,溶液中无CH3COOH
D.d点c(Na+)=2c(CH3COO-)+2c(CH3COOH)
【答案】D
【解析】
20mL2.0mol/LCH3COOH和20mL2.0mol/LNaOH恰好完全反应得到CH3COONa溶液,所以,c点为CH3COONa溶液,a点为CH3COOH溶液,b点为等浓度的CH3COOH和CH3COONa溶液,d点为等浓度的CH3COONa和NaOH溶液,据此解答。
A.a点为CH3COOH溶液,水的电离受到抑制,水电离出的c(H+)<10-7mol/L,A错误;
B.b点的溶液为CH3COOH和CH3COONa等浓度混合的溶液,物料守恒为c(CH3COOH) +c(CH3COO-)=2c(Na+),醋酸会电离:CH3COOH![]() CH3COO-+H+,醋酸根会水解:CH3COO-+H2O
CH3COO-+H+,醋酸根会水解:CH3COO-+H2O![]() CH3COOH+OH-,水解平衡常数
CH3COOH+OH-,水解平衡常数![]() <1.8×10-5,CH3COOH的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Na+)>c(CH3COOH),B错误;
<1.8×10-5,CH3COOH的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Na+)>c(CH3COOH),B错误;
C.c点恰好完全反应,为CH3COONa溶液,但是醋酸根会水解:CH3COO-+H2O![]() CH3COOH+OH-,溶液中有CH3COOH,C错误;
CH3COOH+OH-,溶液中有CH3COOH,C错误;
D.d点加入40mL的NaOH溶液,NaOH多一倍,为等物质的量浓度的NaOH和CH3COONa的混合溶液,有物料守恒c(Na+)=2c(CH3COO-)+2c(CH3COOH),D正确。
答案选D。

 考前必练系列答案
考前必练系列答案