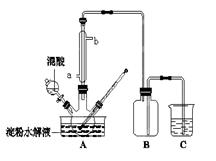
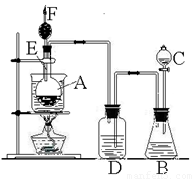
题目内容
(12分)化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列ΔH表示物质燃烧热的是 ;表示物质中和热的是 。
(填“ΔH1”、“ΔH2”和“ΔH3”等)
A.2H2(g)+O2(g) = 2H2O(l) ΔH1
B.C(s)+1/2O2(g) = CO(g) ΔH2
C.CH4(g)+2O2(g) = CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)= CO2(g) ΔH4
E.C6H12O6(s)+6O2(g) = 6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l) ΔH7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是 。
A.C2H6(g)+7/2O2(g) = 2CO2(g)+3H2O(l) ΔH= +2akJ/mol
B.C2H6(g)+7/2O2(g) = 2CO2(g)+3H2O(g) ΔH= -2akJ/mol
C.2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l) ΔH= -4akJ/mol
D.2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(g) ΔH= -4akJ/mol
(3)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),下表是部分化学键的键能数据:

已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如下图所示,则上表中a= 。

(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为 。
(1)ΔH4、ΔH5(2分) ΔH6(2分)
(2)C (2分)
(3) 433.75(3分)
(4)CH3OH(l)+O2(g) = CO2(g)+2H2O(l) ΔH= -725.76kJ/mol(3分)
【解析】
试题分析:(1)燃烧热强调1mol纯物质完全燃烧生成稳定的化合物放出的热量,故ΔH4、ΔH5符合。中和热强调酸碱反应生成1mol水放出的热量,故ΔH6符合;
(2)15g乙烷即0.5mol燃烧放出akJ的热量,则1mol乙烷燃烧放出2aKJ热量,2mol乙烷燃烧放出4aKJ热量,生成液体水,且ΔH<0,故只有C符合,选C;
(3)1mol白磷(P4)的燃烧为P4(s)+5O2(g) = P4O10(s)ΔH=-2378.0kJ/mol,需断 6molP—P和5molO=O,形成12molP—O和4molP=O,所以(4a+12·360 kJ/mol )-(6·197+5·499 kJ/mol )="2378" kJ/mol ,解得a="433.75" kJ/mol;
(4)1g甲醇燃烧生成CO2和液态水时放热22.68kJ ,则32g即1mol甲醇燃烧放出热量为725.76kJ/mol ,且ΔH<0,故甲醇的燃烧热方程为:CH3OH(l)+O2(g) = CO2(g)+2H2O(l) ΔH= -725.76kJ/mol。
考点:燃烧热;中和热
点评:本题考查化学反应热中燃烧热和中和热的知识,题目较为基础,可根据所学知识进行解答。

(4分)室温下,将铁片、铜片、铝片(表面用砂纸打磨过)分别投入浓盐酸、浓硫酸、浓硝酸、浓氢氧化钠溶液四种试剂中,做了12个实验,实验的编号如下表所示。
|
| 浓盐酸 | 浓硫酸 | 浓硝酸 | 浓氢氧化钠溶液 |
| 铝 | 实验1 | 实验2 | 实验3 | 实验4 |
| 铁 | 实验5 | 实验6 | 实验7 | 实验8 |
| 铜 | 实验9 | 实验1O | 实验11 | 实验12 |
回答有关上述实验的下列问题:
(1) 若给以上溶液加热,也不会发生化学反应的实验是 和12(填实验编号)。
(2) 写出实验4发生的离子方程式 。
(4分)室温下,将铁片、铜片、铝片(表面用砂纸打磨过)分别投入浓盐酸、浓硫酸、浓硝酸、浓氢氧化钠溶液四种试剂中,做了12个实验,实验的编号如下表所示。
|
|
浓盐酸 |
浓硫酸 |
浓硝酸 |
浓氢氧化钠溶液 |
|
铝 |
实验1 |
实验2 |
实验3 |
实验4 |
|
铁 |
实验5 |
实验6 |
实验7 |
实验8 |
|
铜 |
实验9 |
实验1O |
实验11 |
实验12 |
回答有关上述实验的下列问题:
(1) 若给以上溶液加热,也不会发生化学反应的实验是 和12(填实验编号)。
(2) 写出实验4发生的离子方程式 。