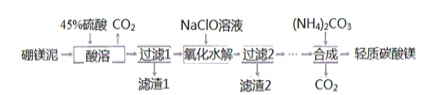
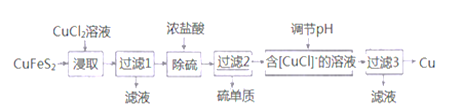
题目内容
【题目】碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种无毒、用途广泛的化工原料,被誉为当今有机合成的“新基石”。
(1)浙江大学用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC的研究开发。已知:
(ⅰ)CO的标准燃烧热:283.0 kJmol﹣1,
(ⅱ)1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
(ⅲ)2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) △H=﹣15.5kJmol﹣1
CH3OCOOCH3(g)+H2O(g) △H=﹣15.5kJmol﹣1
则2CH3OH(g)+CO(g)+1/2O2(g) ![]() CH3OCOOCH3(g)+ H2O(l) △H=______.
CH3OCOOCH3(g)+ H2O(l) △H=______.
该反应在常压和70~120℃条件下就能自发反应的原因是___________________.
(2)甲醇和CO2可直接合成DMC:
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g),但由于甲醇转化率通常不会超过1%,因此制约该反应走向工业化生产.
CH3OCOOCH3(g)+H2O(g),但由于甲醇转化率通常不会超过1%,因此制约该反应走向工业化生产.
①写出该反应平衡常数表达式:______________________________.
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是__________(选填编号)。
A.v正(CH3OH)=2v逆(CO2) B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变 D.容器内压强不变

③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10﹣5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。(计算公式:TON=转化的甲醇的物质的量/催化剂的物质的量)在该温度下,最佳反应时间是_____;4~10h内DMC的平均反应速率是_______.
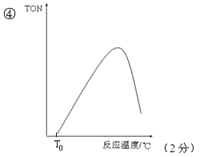
④如果在其它条件不变的情况下,研究反应温度对甲醇转化数(TON)的影响,请在图的坐标系中画出从投入反应物开始,随着反应温度不断升高(不考虑温度对催化剂活性的影响),TON变化的曲线示意图(假设起始温度为T0℃)__________________.

⑤假设在密闭容器中发生上述反应,达到平衡时下列措施能提高TON值的是______.
A.往反应体系中添加催化剂 B.往反应体系中添加吸水剂
C.从反应体系中分离出CO2 D.扩大容器的体积.
【答案】(1)-342.5kJ·mol-1(2分),因为该反应△H<0,△S<0(2分)
(2) ①![]() (2分)
(2分)
② AD(2分)
③ 10(1分) 7.5×10-4mol·L-1·h-1(2分)
⑤B (2分)
【解析】
试题(1)由CO的标准燃烧热:-283.0 kJmol-1得:ⅰCO(g)+1/2O2 (g)====CO2(g);ΔH ="-" 283 kJ·mol-1,1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量得:ⅱH2O(l)====H2O(g);ΔH ="+" 44kJ·mol-1,ⅲ 2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) △H=-15.5 kJmol-1,根据盖斯定律:ⅰ-ⅱ+ⅲ得2CH3OH(g)+CO(g)+ 1/2O2(g)
CH3OCOOCH3(g)+H2O(g) △H=-15.5 kJmol-1,根据盖斯定律:ⅰ-ⅱ+ⅲ得2CH3OH(g)+CO(g)+ 1/2O2(g)![]() CH3OCOOCH3(g)+H2O(l) △H=(-283-44-15.5)kJmol-1=-342.5kJ·mol-1。该反应该反应为放热的熵减反应,根据H-TS<0能自发进行,该反应在低温下自发进行,故该反应在常压和70~120℃条件下就能自发反应是因为该反应△H<0,△S<0。
CH3OCOOCH3(g)+H2O(l) △H=(-283-44-15.5)kJmol-1=-342.5kJ·mol-1。该反应该反应为放热的熵减反应,根据H-TS<0能自发进行,该反应在低温下自发进行,故该反应在常压和70~120℃条件下就能自发反应是因为该反应△H<0,△S<0。
(2)① 化学平衡常数等于生成物平衡浓度系数次幂的积与反应物平衡浓度系数次幂的积的比,根据化学方程式写出该反应平衡常数表达式为:![]() 。②A、v正(CH3OH)= 2v逆(CO2) ,正逆反应速率相等,反应已达平衡状态,正确;B、反应从正向开始,CH3OCOOCH3与H2O的物质的量之比不随反应的进行而变化,不能作为平衡标志,错误;C、该反应在恒容密闭容器进行,容器内气体的质量不变,气体的密度不随反应的进行而变化,气体密度不变,不能作为平衡标志,错误;D、该反应为反应前后气体物质的量减小的反应,容器内压强不变,说明反应已达平衡,正确,选AD。
。②A、v正(CH3OH)= 2v逆(CO2) ,正逆反应速率相等,反应已达平衡状态,正确;B、反应从正向开始,CH3OCOOCH3与H2O的物质的量之比不随反应的进行而变化,不能作为平衡标志,错误;C、该反应在恒容密闭容器进行,容器内气体的质量不变,气体的密度不随反应的进行而变化,气体密度不变,不能作为平衡标志,错误;D、该反应为反应前后气体物质的量减小的反应,容器内压强不变,说明反应已达平衡,正确,选AD。
③根据图像分析反应时间为10h时TON最大,甲醇的转化率最高,故最佳反应时间是10h;根据题给信息和图像知4h时转化的甲醇的物质的量=20×6×10-5mol=1.2×10-3mol,10h时转化的甲醇的物质的量="35" ×6×10-5mol =2.1×10-3mol ,则4~10 h内甲醇的物质的量变化,△n(CH3OH)=0.9×10-3mol ,v (DMC)="1/2v" (CH3OH)=△n(CH3OH)/2V△t=7.5×10-4mol·L-1·h-1;④在其它条件不变的情况下,随着反应温度不断升高,从投入反应物开始,转化的甲醇的物质的量逐渐增大,TON逐渐增大,当反应达到平衡状态,转化的甲醇的物质的量最大,TON最大,该反应放热,再升高温度,平衡逆向移动,转化的甲醇的物质的量又逐渐减少,TON又逐渐减小,图像见答案。⑤A、往反应体系中添加催化剂,平衡不移动,转化的甲醇的物质的量不变,催化剂的物质的量增加,TON值减小,错误;B、往反应体系中添加吸水剂 ,平衡正向移动,转化的甲醇的物质的量增大,催化剂的物质的量不变,TON值增大,正确;C、从反应体系中分离出CO2,平衡逆向移动,转化的甲醇的物质的量减小,催化剂的物质的量不变,TON值减小,错误;D、扩大容器的体积,平衡逆向移动,转化的甲醇的物质的量减小,催化剂的物质的量不变,TON值减小,错误,选B。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案