题目内容
【题目】南京工业大学某研究团队最近在《Nature Communications》刊文介绍了他们开发的一种新型催化剂——反钙钛矿基非贵金属催化剂,这种价廉的新型催化剂结合了钙钛矿结构的灵活性和过渡金属氮(碳)化合物的高导电性、优异电催化性等优点,理论上来说是一种很有发展潜力的析氧反应电催化剂。回答下列问题:
(1)基态氮原子核外未成对电子数为________,基态碳原子核外电子云有_______个伸展方向。
(2)在周期表中,N、O、F是位于同周期且相邻的三种元素,第一电离能最大的元素和最小的元素组成一种只含极性键的化合物M,M分子的立体构型是_________,中心原子的杂化类型是________。
(3)在周期表中,钡位于第六周期ⅡA族,钛酸钡、钛酸钙的熔点分别为1625℃、1975℃,二者熔点差异的原因为__。
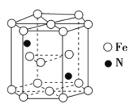
(4)钛酸钙的晶胞如图所示,钛酸钙的化学式为_____________;1个钛离子与________个氧离子等距离且最近,这些氧离子可构成正八面体,钛离子位于该正八面体的体心。已知钛酸钙的晶胞参数为a nm,则该正八面体的边长为________pm。
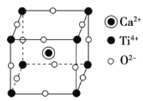
(5)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示,六棱柱底边边长为x cm,高为y cm,NA为阿伏加德罗常数的值,则晶胞的密度为________________g·cm-3(列出计算式即可)。
【答案】3 3 V形 sp3 同为离子晶体,Ca2+的半径小于Ba2+,CaTiO3的晶格能大于BaTiO3 CaTiO3 6 500![]() a
a 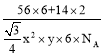
【解析】
(1)基态氮原子的核外电子排布式为1s22s22p3,基态C原子的核外电子排布式为1s22s22p2,由电子排布式分析可得;
(2)第一电离能的大小顺序为F>N>O,则M为只含极性键的OF2,由价层电子对数和孤对电子对数确定原子杂化方式和分子空间构型;
(3)两种晶体都是离子晶体,从离子半径角度分析,比较晶格能的大小;
(4)由分摊法计算钛酸钙的化学式,1个钛离子周围有6个氧离子与其等距离且最近,正八面体边长等于晶胞边长的![]() 倍;
倍;
(5) 由分摊法计算可得。
(1)基态N原子的核外电子排布式为1s22s22p3,s能级有1个轨道,1s、2s电子为成对电子,2p能级有3个轨道,3个电子各占据1个轨道,是未成对电子,则未成对电子数为3个;基态C原子的核外电子排布式为1s22s22p2,s能级上电子云只有1个伸展方向,2p能级上只填充2个电子,有2个伸展方向,共有3个伸展方向,故答案为:3;3;
(2)同一周期元素的第一电离能随着原子序数增大而增大,氮N元素的2p轨道电子处于半充满状态,稳定性较强,则第一电离能大小的顺序为F>N>O,第一电离能最大的F元素和最小的O元素组成一种只含极性键的化合物M的分子式为OF2,OF2分子中O原子的价层电子对数为4,孤对电子对数为2,则O原子的杂化方式为sp3杂化,分子的空间构型为V形,故答案为:V形;sp3;
(3)离子晶体具有较高的熔点,离子晶体的晶格能越大,熔点越高,由熔点可知,钛酸钡、钛酸钙均为离子晶体,Ca2+的半径小于Ba2+,CaTiO3的晶格能大于BaTiO3,则钛酸钡的熔点小于钛酸钙,故答案为:同为离子晶体,Ca2+的半径小于Ba2+,CaTiO3的晶格能大于BaTiO3;
(4)由晶胞结构可知,晶胞中钙离子的个数为1,钛离子的个数为8×![]() =1,氧离子个数为12×
=1,氧离子个数为12×![]() =3,离子个数比为1:1:3,则钛酸钙的化学式为CaTiO3;1个钛离子周围有6个氧离子与其等距离且最近,正八面体边长等于晶胞边长的
=3,离子个数比为1:1:3,则钛酸钙的化学式为CaTiO3;1个钛离子周围有6个氧离子与其等距离且最近,正八面体边长等于晶胞边长的![]() 倍,1 nm=103 pm,则该正八面体的边长为
倍,1 nm=103 pm,则该正八面体的边长为![]() ×103 pm=500
×103 pm=500![]() a pm,故答案为:CaTiO3;6;500
a pm,故答案为:CaTiO3;6;500![]() a;
a;
(5)由晶胞结构可知,晶胞含有12×![]() +2×
+2×![]() +3=6个Fe原子,含有2个N原子,六棱柱的底面由6个正三角形构成,正三角形的高为
+3=6个Fe原子,含有2个N原子,六棱柱的底面由6个正三角形构成,正三角形的高为![]() x cm,每个正三角形的面积为
x cm,每个正三角形的面积为![]() x2 cm2,晶胞的体积为
x2 cm2,晶胞的体积为![]() cm3,则晶胞的密度为
cm3,则晶胞的密度为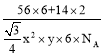 g/ cm3,故答案为:
g/ cm3,故答案为: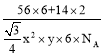 。
。

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案