题目内容
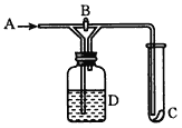
【题目】ClO2与Cl2的氧化性相近.在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过题图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究. 
(1)仪器C的名称是 . 安装F中导管时,应选用图2中的 .
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.该反应中氧化剂与还原剂物质的量之比为 , 为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(填“快”或“慢”).
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2 , 此时F中溶液的颜色不变,则装置C的作用是 .
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式为 , 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是
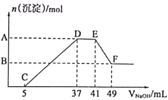
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如题9图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是 , 原因是 .
【答案】
(1)干燥管;b
(2)1:1;慢
(3)吸收Cl2
(4)4H++5ClO2﹣=Cl﹣+4ClO2↑+2H2O;验证是否有ClO2 生成
(5)稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2 , 能较长时间维持保鲜所需的浓度
【解析】 解:(1)仪器C具有球形特征,据此可知该仪器是干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,所以答案是:干燥管;b;(2)在氧化还原反应中,反应物中元素化合价降低的物质为氧化剂,化合价升高的物质为还原剂,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O反应中,NaClO3中氯元素化合价由+5价降低为+4价,NaClO3是氧化剂,还原产物是ClO2;HCl中氯元素化合价由﹣1价升高为0价,HCl是还原剂,氧化产物是Cl2 , 根据氧化产物是Cl2 , 可知起还原剂与酸性的氯化氢各占一半,所以该反应中氧化剂与还原剂物质的量之比为1:1,为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,所以答案是:1:1;慢;(3)氯气有毒,能够与碘化钾反应,被碘化钾溶液吸收,所以F的作用为吸收Cl2 , 所以答案是:吸收Cl2;(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2﹣=Cl﹣+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,所以答案是:4H++5ClO2﹣=Cl﹣+4ClO2↑+2H2O;验证是否有ClO2 生成;(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2 , 能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,所以答案是:稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2 , 能较长时间维持保鲜所需的浓度.

【题目】二氧化锆是重要的耐高温材料、陶瓷绝缘材料.以锆英砂(主要成分为ZrSiO4 , 还含有少量Fe2O3、Al2O3、SiO2等杂货)为原料制备二氧化锆(ZrO2)的工艺流程如图所示. 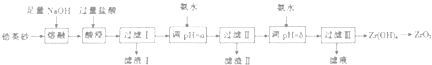 已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表
离子 | Fe3+ | AP+ | ZrO2+ |
开始沉淀pH | 1.9 | 3.3 | 6.2 |
完仝沉淀pH | 3.2 | 5.2 | 8.0 |
(1)经熔融后,锆英砂中Zr元素以(写化学式)形式存在,写出酸浸时生成Al3+、Fe3+的离子方程式:
(2)滤渣I的主要成分的名称为
(3)向过滤Ⅰ所得溶液中加氨水调pH=a,其目的是然后继续加氨水至pH=b的范围是
(4)向过滤Ⅲ所得溶液中加入CaCO2粉末并加热,可得CO2和另一种气体,该反应的离子方程式为