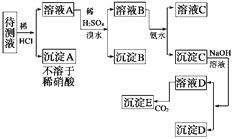
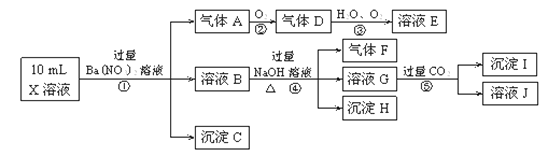
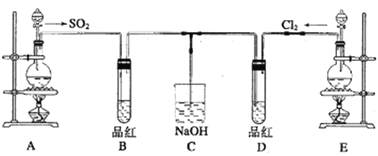
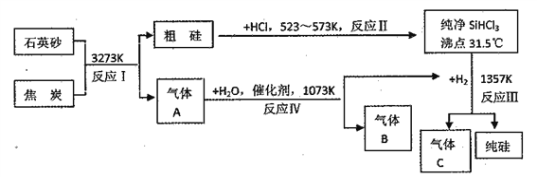
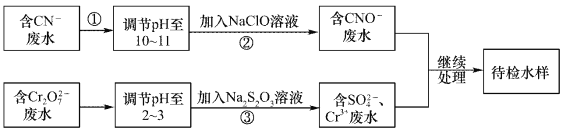
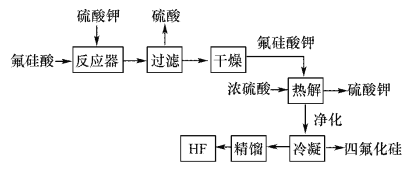
��Ŀ����
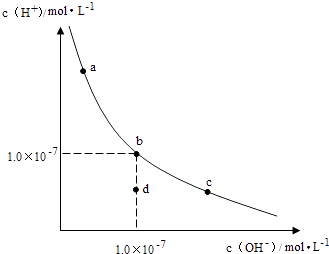
����Ŀ����t��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t��ʱAgCl��Ksp=4��10��10 �� ����˵������ȷ���ǣ� �� 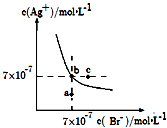
A.��ͼ��a���Ӧ����AgBr�IJ�������Һ
B.��t��ʱ��Ksp��AgBr��=4.9��10��13
C.��t��ʱ��AgCl��s��+Br����aq��AgBr��s��+Cl����aq����ƽ�ⳣ��K��816
D.��AgBr�ı�����Һ�м���NaBr���壬��ʹ��Һ��b�㵽��c��
���𰸡�D
���������⣺A������ͼ���֪����a��ʱQc=c��Ag+��c��Br������Ksp������a��ΪAgBr�IJ�������Һ����A��ȷ��
B�����ͼ��c���c��Ag+����c��Br������֪�����¶���AgBr��Ksp=7��10��7��7��10��7=4.9��10��13 �� ��B��ȷ��
C����ӦAgCl��s��+Br����aq��AgBr��s��+Cl����aq����ƽ�ⳣ��Ϊ��K= ![]() =
= ![]() =
= ![]() ��816����C��ȷ��
��816����C��ȷ��
D����AgBr������Һ�м���NaBr�����c��Br���������ܽ�ƽ�������ƶ���c��Ag+����С����D����
��ѡD��
A����a��ʱQc=c��Ag+��c��Br������Ksp���ж�AgBrΪ��������Һ��
B������ͼ��c���c��Ag+����c��Br�����ɵø��¶���AgBr��KspΪ4.9��10��13��
C������K= ![]() =
= ![]() �����ƽ�ⳣ�����ɣ�
�����ƽ�ⳣ�����ɣ�
D����AgBr������Һ�м���NaBr�����c��Br���������ܽ�ƽ�������ƶ���c��Ag+����С��

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�