题目内容
【题目】某待测溶液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ca2+、Ba2+、NH4+等离子。进行了下述实验(所加酸、碱、氨水、溴水都是过量的)。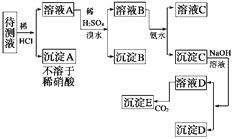
根据实验回答下列问题:
(1)判定待测液中有无Ba2+、Ca2+ , 并写出理由。
(2)写出沉淀D的化学式:。
(3)写出从溶液D生成沉淀E的反应的离子方程式。
【答案】
(1)
一定含有Ba2+、Ca2+中的一种或两种。因为BaSO4不溶于水,CaSO4微溶于水,沉淀B一定是这两种物质中的一种或两种。
(2)Fe(OH)3
(3)
2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】由图示可知,A应为AgCl溶液A加稀H2SO4是为了沉淀Ba2+或Ca+ , 加Br2水是氧化可能存在的Fe+ , 即B为BaSO4或CaSO4;沉淀 D不溶于NaOH,为Fe(OH)3 , 而E为Al(OH)3。

练习册系列答案
相关题目
【题目】下列实验操作或事实与预期实验目的或所得结论对应错误的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有Fe3+ |
B | CaO | 实验室用生石灰制备NaOH溶液 |
C | 新收集的酸雨 | 酸雨中可能含有H2SO3 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于二元酸 |
A. A B. B C. C D. D