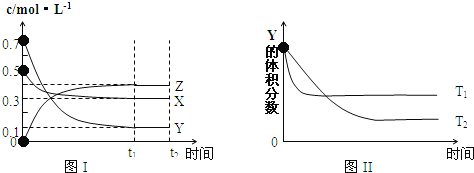
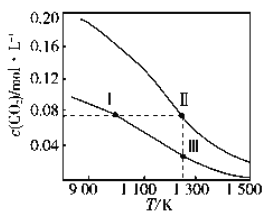
题目内容
【题目】已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同且恒容的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
A. Q1=2Q2=92.4 B. 92.4 >Ql>2Q2 C. 92.4=Q1>2Q2 D. 92.4 >Q1=2Q2
【答案】B
【解析】试题分析:由题意可得热化学方程式:N2(气)+3H2(气)![]() 2 NH3(气) ΔH=-92.4 kJ/mol . ①向密闭容器甲中通入1 molN2和3 mol H2,由于该反应是可逆反应,反应物不可能完全转化为生成物,所以达到平衡时放出热量Q1kJ<92.4 kJ÷2。②由于反应是在容积相同且恒容的密闭容器中进行。若平衡不发生移动,由于物质的量为①的一半,放出的热量也是原来的一半。但是由于该反应的正反应是气体体积减小的反应。物质的量减少,压强减小,根据平衡移动原理:减小压强,化学平衡向逆反应方向移动,所以放出的热量要比一半少。因此热量关系为92.4 >Ql>2Q2。故选项为B。
2 NH3(气) ΔH=-92.4 kJ/mol . ①向密闭容器甲中通入1 molN2和3 mol H2,由于该反应是可逆反应,反应物不可能完全转化为生成物,所以达到平衡时放出热量Q1kJ<92.4 kJ÷2。②由于反应是在容积相同且恒容的密闭容器中进行。若平衡不发生移动,由于物质的量为①的一半,放出的热量也是原来的一半。但是由于该反应的正反应是气体体积减小的反应。物质的量减少,压强减小,根据平衡移动原理:减小压强,化学平衡向逆反应方向移动,所以放出的热量要比一半少。因此热量关系为92.4 >Ql>2Q2。故选项为B。

练习册系列答案
相关题目