题目内容
【题目】碳酸锂广泛应用于化工、冶金等行业。工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如下:
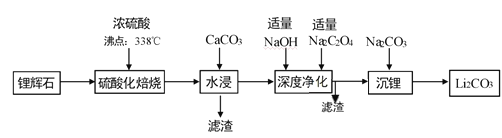
已知:①CaC2O4难溶于水;②Li2CO3的溶解度(g/L)。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
请回答下列问题:
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为___________。
(2)“深度净化”时,加入适量Na2C2O4的目的是__________________。
(3)“沉锂”需要在95℃以上进行,主要原因是_____________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH 溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是__________________,宜选用_________(“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的化学方程式是________________________。
【答案】Li2O·Al2O3·4SiO2 除去Ca2+ 温度越高,碳酸锂溶解度越小,可以增加产率 2Cl--2e-=Cl2↑ 阳 2LiOH+NH4HCO3![]() Li2CO3+2H2O+NH3↑
Li2CO3+2H2O+NH3↑
【解析】
由制备流程可知,锂辉石加硫酸,浸取焙烧,氧化铝、氧化锂溶解,二氧化硅不反应,水浸时加入碳酸钙,除去未反应的硫酸,同时调节溶液pH值,可以将Al3+转化为氢氧化铝沉淀,过滤除去不溶物,滤液再进行深度净化后主要为Li2SO4、Na2SO4,最后加入Na2CO3,转化为溶解度更小Li2CO3析出,据此分析。
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示,Li元素化合价+1价,铝元素+3价,氧元素-2价,硅元素+4价,根据化合价代数和为0,可以确定Li2Al2Si4Ox中x=12,所以该化合物用氧化物的形式表示为Li2O·Al2O3·4SiO2;
(2)由于滤液中含有钙离子,而草酸根难溶,则“深度净化”时,加入适量Na2C2O4的目的是除去Ca2+。
(3)根据表中数据可知温度越高,碳酸锂溶解度降低,减少碳酸锂溶解,可以增加产率,因此“沉锂”需要在95℃以上进行;
(4)①a中,阳极是氯离子发生失去电子的氧化反应,则电极反应式是2Cl--2e-=Cl2↑,为防止生成的氯气溶解在碱液中,宜选用阳离子交换膜。
②电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3,则b中根据原子守恒可知生成Li2CO3的化学方程式是2LiOH+NH4HCO3![]() Li2CO3+2H2O+NH3↑。
Li2CO3+2H2O+NH3↑。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案