题目内容
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和NH3H2O反应的中和热△H=2×(﹣57.3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+2×283.0 kJ/mol
【答案】D
【解析】解:A、催化剂能降低反应的活化能从而改变反应速率,但不改变化学平衡,则不能改变反应的反应热,故A错误;B、氨水的电离是吸热过程,而且两者的物质的量不知,故B错误;
C、可燃物的燃烧也需要加热,但属于放热反应,故C错误;
D、CO(g)的燃烧热是283.0kJ/mol,CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0kJ/mol,因此2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol,故D正确;
O2(g)=CO2(g)△H=﹣283.0kJ/mol,因此2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol,故D正确;
故选D.

【题目】含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.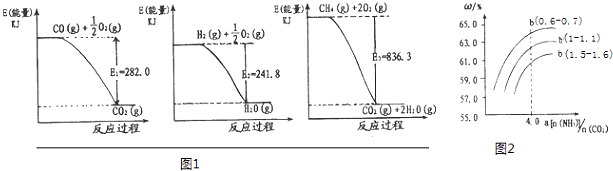
(1)氨是一种重要化工原料.合成氨原料气H2 , 可用天然气为原料制得,有关反应能量变化如图1所示.则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物.(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如下表:
时间/S | 0 | 20 | 40 | 60 | 80 |
N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在150℃达到平衡时,该反应平衡常数K= . (填数值)
②若最初通入N2O4 , 在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为 .
(ii)氨氧化制HNO3的尾气中含有NO和NO2 , 且n(NO):n(NO2)=1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污
染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)图2表示合成塔中氨碳比a与CO2转化率ω的关系.a为[n(NH3):n(CO2)],b为水碳比[n(H2O):n(CO2)].则:
①b应控制在;
A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 .