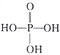
题目内容
【题目】(1)0.5 mol Na2CO3中含有___________个Na+。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是____________。
(3)配制90 mL 0.1 mol/L CuSO4溶液,需要胆矾________g。
(4)氧化还原反应3S+6KOH=2K2S+K2SO3+3H2O中,氧化剂与还原剂的物质的量之比为_____________,若反应中消耗了0.6molS,则反应中转移的电子为________mol。
(5)现有下列10种物质:①H2O、②Mg、③CH3COOH、④NaOH、⑤CuSO4·5H2O、⑥碘酒、⑦C2H5OH、⑧盐酸,(将序号填在相应的空格内)其中,属于强电解质的是_____________。
【答案】NA或6.02×1023 NH3 2.5 2:1 0.8 ④⑤
【解析】
(1)由化学式可知,钠离子的物质的量是碳酸钠的2倍,再根据N=nNA计算Na+的数目;
(2)四种气体的相对分子质量分别为36.5、17、44、32,由m=nM可知物质的量由大到小的顺序是NH3>O2>HCl>CO2。同温同压下,物质的量最大的就是体积最大的;
(3)配制90 mL 0.1 mol/L CuSO4溶液,实验室没有90 mL规格的容量瓶必须配制100mL,根据n=cV可知需要硫酸铜的物质的量;
(4) 在3S+6KOH=K2SO3+2K2S+3H2O反应中,S元素化合价分别由0价升高为+4价,被氧化,降低为-2价,被还原,反应中硫既作氧化剂又作还原剂,根据还原产物与氧化产物的化学计量数进行判断;
(5)在水溶液中能完全电离的电解质属于强电解质。
(1)由化学式可知,钠离子的物质的量是碳酸钠的2倍,0.5 mol Na2CO3中n(Na+)=0.5mol×2=1mol,故Na+的数目为NA或6.02×1023;
(2)四种气体的相对分子质量分别为36.5、17、44、32,由m=nM可知质量都是50g的四种气体物质的量由大到小的顺序是NH3>O2>HCl>CO2;同温同压下,物质的量最大的就是体积最大的,所以气体体积最大的是NH3;
(3)配制90 mL 0.1 mol/L CuSO4溶液,实验室没有90 mL规格的容量瓶必须配制100mL,根据n=cV可知需要硫酸铜的物质的量是0.1L×0.1mol/L=0.01mol,则需要CuSO4·5H2O的质量是0.01mol×250g/mol=2.5g;
(4)在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为-2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知,氧化剂和还原剂的物质的量之比为2:1;
根据反应可知,若反应中消耗了0.6molS,则反应中转移的电子为![]() 0.8mol;
0.8mol;
(5) 在水溶液中能完全电离的电解质属于强电解质。①H2O部分电离 属于弱电解质、②Mg为单质既不是电解质也不是非电解质、③CH3COOH部分电离属于弱电解质、④NaOH在水溶液中完全电离属于强电解质、⑤CuSO4·5H2O在水溶液中完全电离属于强电解质、⑥碘酒为混合物既不是电解质也不是非电解质、⑦C2H5OH是在水溶液中和熔融状态下不能导电的化合物,属于非电解质、⑧盐酸是混合物既不是电解质也不是非电解质,故属于强电解质的是④⑤。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】实验室从海带中提取碘的操作过程中,仪器选用不正确的是 ( )
选项 | A | B | C | D |
操作 | 称取3g左右的剪碎了的干海带 | 灼烧干海带碎片至完全变成灰烬 | 过滤煮沸后的海带灰与水的混合液 | 用四氯化碳从氧化后的海带灰浸取液中提取碘 |
选用仪器 | 托盘天平 | 蒸发皿 | 普通漏斗 | 分液漏斗 |
A. A B. B C. C D. D