题目内容
在一密闭容器中进行如下反应:2SO2(气)+O2(气)  2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L |
| B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L |
| D.SO3为0.4mol/L |
B
解析试题分析:A、当SO3全部转化为SO2和O2时是SO2为0.4mol/L、O2为0.2mol/L ,不是反应达平衡时,错误;B、有可能存在,正确;C、当SO2为0.15mol/L时,SO3为0.25mol/L ,错误;D、 当SO2和O2全部转化为SO3时,SO3为0.4mol/L,不是反应达到平衡时,错误。
考点:考查化学平衡。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下列说法正确的是( )
| A.ΔH<0、ΔS>0的反应在温度低时不能自发进行 |
| B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g)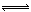 cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是( )
cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是( )
| A.反应速率增大 | B.平衡向正反应方向移动 |
| C.N的转化率提高 | D.W的体积分数降低 |
已知2SO2(g) + O2(g) 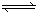 2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
| A.若降低温度,可以减慢反应速率 |
| B.催化剂既能加快化学反应速率,又能提高SO2的转化率 |
| C.氧气足量时,SO2不能完全转化为SO3 |
| D.达到平衡时,SO2和SO3的浓度一定相等 |
已知4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.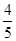 v(NH3)=v(O2) v(NH3)=v(O2) | B.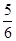 v(O2)=v(H2O) v(O2)=v(H2O) |
C.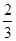 v(NH3)=v(H2O) v(NH3)=v(H2O) | D.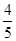 v(O2)=v(NO) v(O2)=v(NO) |
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氨气的平均速率:ν(NH3)=0.3mol/(L·s),则2s末NH3的浓度为
| A.0.60mol/L | B.0.50mol/L | C.0.45mol/L | D.0.55mol/L |
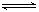 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是  2HI的平衡体系,加压后密闭体系中的混合气体密度增加
2HI的平衡体系,加压后密闭体系中的混合气体密度增加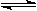 2C(g)+3D(g),达到平衡的标志是
2C(g)+3D(g),达到平衡的标志是