题目内容
在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g)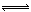 cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是( )
cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是( )
| A.反应速率增大 | B.平衡向正反应方向移动 |
| C.N的转化率提高 | D.W的体积分数降低 |
D
解析试题分析:A、将密闭容器的体积扩大1倍,则气体的压强减小,化学反应速率减慢,故A错误;B、在恒温下,将密闭容器的体积扩大1倍,原则上是M气体的浓度为原来的一半,即为0.25mol/L,但是当再达平衡时,测得M气体的浓度为0.3mol/L>0.25mol/L,说明化学平衡向着逆反应方向进行,故B错误;C、化学平衡向着逆反应方向进行,N的转化率减小,故C错误;D、化学平衡向着逆反应方向进行,W的体积分数降低,故D正确.故选D.
考点:本题考查了点评:本题考查了外界条件对化学平衡的影响,注意知识的积累是解题的关键,难度不大。

 口算能手系列答案
口算能手系列答案实验室用足量铁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是( )
| A.CH3COONa固体 | B.NaOH溶液 | C.(NH4)2 SO4粉末 | D.K2 SO4固体 |
已知某可逆反应在密闭容器中进行:A(g)+2B(g)  3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )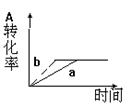
| A.增大A的浓度 | B.增大容器的体积 |
| C.加入催化剂 | D.升高温度 |
在一定温度下可逆反应N2+3H2 2NH3已达到平衡,下列有关说法正确的 ( )
2NH3已达到平衡,下列有关说法正确的 ( )
①1个N≡N键断裂的同时,有3个H—H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N—H 键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成n molN2,同时生成2n molNH3
⑦气体的平均相对分子质量不再改变
⑧N2 H2 NH3的分子数一定为1∶3∶2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变
| A.①②③④⑤⑥⑦⑨ | B.①②③⑤⑥⑩ |
| C.③④⑤⑥⑦⑧ | D.①②③⑤⑥⑦⑨⑩ |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)  2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是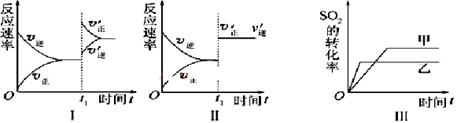
| A.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| B.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
对于化学反应方向的确定,下列说法正确的
| A.反应的焓变是决定反应能否自发进行的唯一因素 |
| B.温度、压强一定时,放热反应能自发进行 |
| C.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| D.固体的溶解过程与焓变无关 |
在一密闭容器中进行如下反应:2SO2(气)+O2(气)  2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L |
| B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L |
| D.SO3为0.4mol/L |
一定条件下,可逆反应C(s)+CO2(g)  2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )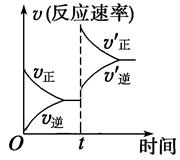
| A.①②③④ | B.①③ | C.①② | D.①③④ |
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是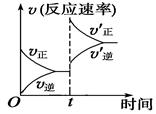
| A.加压 | B.升温 |
| C.增大水蒸气浓度 | D.增大碳的物质的量 |