题目内容
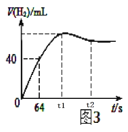
【题目】工业制硫酸在接触室中发生的主要反应为2SO2(g)+O2(g)![]() 2SO3(g)。在一定温度下,向2L密闭容器内投入4molSO2(g)和2molO2(g)发生上述反应,n(SO2)随时间的变化如表所示:
2SO3(g)。在一定温度下,向2L密闭容器内投入4molSO2(g)和2molO2(g)发生上述反应,n(SO2)随时间的变化如表所示:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(SO2)(mol) | 4 | 3.2 | 1.6 | 1.4 | 1.4 |
(1)用SO3表示从0~2s内该反应的平均速率v(SO3)=___。
(2)该反应达到最大限度时SO2的转化率为___。
(提示:转化率=![]() ×100%)
×100%)
(3)该反应达到最大限度时O2的浓度为___。
(4)下列叙述能说明上述反应达到平衡状态的是___。
A.容器内压强保持不变
B.v(SO2)=2v(O2)
C.SO3的浓度不再变化
D.SO2、O2、SO3为浓度之比为2∶1∶2
E.单位时间内每消耗2molSO2,同时生成2molSO3
【答案】0.6mol/(Ls) 65% 0.35mol/L AC
【解析】
(1)0~2s内△n(SO2)=4mol-1.6mol=2.4mol,根据方程式2SO2(g)+O2(g)![]() 2SO3(g)可知该时间段内△n(SO3)=2.4mol,容器体积为2L,所以v(SO3)=
2SO3(g)可知该时间段内△n(SO3)=2.4mol,容器体积为2L,所以v(SO3)=![]() = 0.6mol/(Ls);
= 0.6mol/(Ls);
(2)根据表格可知3s后二氧化硫浓度不在改变,说明此时反应已经达到平衡,此时二氧化硫的转化率为![]() =65%;
=65%;
(3)平衡时△n(SO2)=2.6mol,根据方程式可知△n(O2)=1.3mol,则剩余氧气的物质的量为2mol-1.3mol=0.7mol,容器体积为2L,所以c(O2)=![]() =0.35mol/L;
=0.35mol/L;
(4)A.容器体积恒定,平衡正向移动时气体的物质的量减小,容器内压强减小,所以当压强不变时说明反应达到平衡,故A正确;
B.未指明正反应速率还是逆反应速率,故B错误;
C.反应达到平衡时,各物质的浓度不再改变,所以三氧化硫浓度不再变化说明反应达到平衡,故C正确;
D.平衡时各物质的浓度不再改变,但比值不一定,与转化率有关,故D错误;
E.只要反应进行单位时间内每消耗2molSO2,就会同时生成2molSO3,故E错误;
综上所述答案为AC。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___,形成的单质是半导体的是___(填元素名称)。
(2)⑥与⑨形成的化合物的电子式为___,①与②形成的最简单化合物的结构式为___。
(3
(4)气态氢化物最稳定的是___(填化学式),②、③、⑧的原子半径最小是__(填素符号)。
(5)④与⑧形成的化合物的属于___(填“离子化合物”或“共价化合物”),该晶体属于___晶体(填“离子”、“分子”、“原子”)。