题目内容
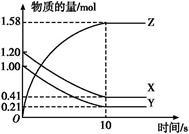
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应反应过程中H2、N2和NH3物质的量变化如下图所示,下列说法正确的是
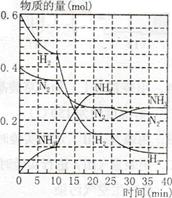

| A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min) |
| B.从曲线可以看出,反应进行到10min至20min时可能是使用了催化剂 |
| C.从曲线可以看出,反应进行至25min时,增加了0.1mol氨气 |
| D.在25min平衡正向移动但达到新平衡后NH3的体积分数比原平衡小 |
D
试题分析:A、到达第一次平衡的时间是10min,此时N2的物质的量减少0.05mol,所以N2的平均反应速率为0.05mol/2L/10min="0.0025" mol/(L·min),错误;B、反应进行到10min至20min时,平衡移动了说明不是加了催化剂,因为催化剂对平衡的移动无影响,错误;C、从曲线可以看出,反应进行至25min时,氮气、氢气的物质的量没变化,而氨气的物质的量降为0.2mol,减少了0.1mol,错误;D、25min时氨气减少0.1mol,所以平衡正向移动,通过计算可知氨气的体积分数还是比原平衡减小了(或勒夏特列原理),正确,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
 I3-(aq),其平衡常数表达式为
I3-(aq),其平衡常数表达式为
 O2(g)
O2(g) SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是( )
SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是( )