题目内容
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.16gO2和O3的混合气体中含有的分子数为0.5NA
B.0.3molAgNO3受热完全分解(2AgNO3=2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为 0.25NA
C.0.5NA个氯气分子所占体积约是11.2L
D.2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
【答案】D
【解析】
A.16gO2的物质的量是0.5mol,含有的分子数目是0.5NA;16gO3的物质的量是![]() mol,其中含有的分子数目是
mol,其中含有的分子数目是![]() NA,故16gO2和O3的混合气体中含有的分子数小于0.5NA,A错误;
NA,故16gO2和O3的混合气体中含有的分子数小于0.5NA,A错误;
B.根据方程式可知0.3molAgNO3受热完全分解,发生反应2AgNO3=2Ag+2NO2↑+O2↑,产生0.3molNO2、0.15molO2,用排水法收集气体时,会发生反应:4NO2+O2+2H2O=4HNO3,O2过量,最后剩余O2的物质的量是0.075mol,因此收集到气体的分子数为 0.075NA,B错误;
C.缺条件,不能确定气体的体积,C错误;
D.2.3gNa的物质的量是0.1mol,由于Na是+1价的金属,所以2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA,D正确;
故合理选项是D。

【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
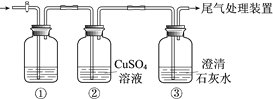
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
【题目】用图中所示的装置进行实验,实验现象和预测不一致的是 ( )
| ①中的物质 | ②中的物质 | 预测现象 | |
A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 | |
B | 浓氨水 | 浓盐酸 | ③中有白烟 | |
C | 饱和氯水 | Na2S溶液 | ②中生成淡黄色沉淀 | |
D | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红后褪色 |
A.AB.BC.CD.D