题目内容
【题目】如图所示装置中,当线路接通时,发现M滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化。回答:
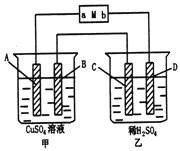
(1)甲、乙分别是什么装置?_______、________。
(2)写出A、B、C、D的电极名称以及电极材料和电极反应式。
A极:__________;B极:__________;C极:__________;D极:__________;
【答案】 原电池 电解池; (负极Zn): 2Zn-4e-=Zn2+ (正极Ag): 2Cu2++4e- =2Cu C极:(阳极Pt):4OH- -4e-=2H2O+O2↑ D极:(阴极 Cu): 4H++4e- = 2H2↑
【解析】发现M(用Na2SO4溶液的石蕊试液浸润过)a端显蓝色,则a端为碱性,氢离子放电,为阴极,b端显红色,则b端为酸性,氢氧根离子放电,是阳极,和电源的正极相连的是阳极,和电源的负极相连的是阴极,即a是阴极,b是阳极。
(1)甲中电极材料是锌-银,金属锌可以和硫酸铜之间发生置换反应,属于自发的氧化还原反应,所以该装置属于原电池,金属锌是负极,和a相连,银是正极,乙中电极材料是铂-铜,且乙中两极不发生变化,该装置属于电解池,金属铜是阴极,为D电极,Pt是阳极材料,故答案为:原电池;电解池;
(2)A装置属于原电池,金属锌是负极,和a相连,即为A极,电极方程式为Zn-2e-=Zn2+,银是正极,即为B极,电极方程式为Cu2++2e-=Cu,乙中电极材料是铂-铜,且乙中两极不发生变化,该装置属于电解池,金属铜是阴极,为D电极,阴极上氢离子得电子生成氢气,其电极方程式为2H++2e-=H2↑,Pt是阳极材料,即为C电极,C极上氢氧根离子失电子生成氧气,其电极方程式为:4OH-+4e-=2H2O+O2↑;故答案为:(负极Zn ):Zn-2e-=Zn2+;(正极Ag):Cu2++2e-=Cu;(阳极Pt):4OH-+4e-=2H2O+O2↑;(阴极Cu):2H++2e-=H2↑。

【题目】0.2 mol Na![]() O2与足量CO2完全反应后,下表对生成物Na2CO3和O2的描述中正确的是
O2与足量CO2完全反应后,下表对生成物Na2CO3和O2的描述中正确的是
Na2CO3的质量 | 关于O2的描述 | |
A | 21.2 g | O2的摩尔质量是36 g·mol-1 |
B | 21.6 g | 生成标准状况下O2的体积为2.24 L |
C | 21.6 g | O2的摩尔质量是34 g·mol-1 |
D | 22.4 g | 生成标准状况下O2的体积为2.24 mL |
A. A B. B C. C D. D
