题目内容
【题目】常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图。下列分析正确的是( )
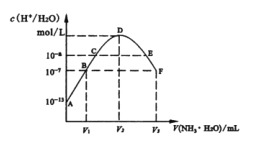
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14-a
C.E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.B到D、D到F所加氨水体积一定相等
【答案】C
【解析】
试题分析:A、根据20mL的稀H2S04溶液中,水电离出的氢离子浓度是10-13,结根据水的离子积得到硫酸电离出的氢离子浓度是0.1mol/L,稀硫酸的浓度为0.05mol/L,A错误;B、C点的溶液中水电离出的氢离子浓度是10-a,此时的溶液显示酸性,铵根离子水解所致,所以水电离程度增大,pH=a,B错误;C、E溶液显示酸性,硫酸铵和氨水的混合物,得到的溶液中铵根离子的水解程度较强,所以c(NH4+)>c(SO42-)>c(H+)>c(OH-),C正确;D、B到D水的电离程度增加,是硫酸铵生成阶段,铵根离子水解显酸性,促进水的电离,D到F,是因为加入的氨水抑制水的电离,使水的电离程度逐渐减小,两个阶段铵根离子的水解程度不一样,所以加氨水体积不相等,D错误.

练习册系列答案
相关题目