题目内容
13.某主族元素R的最高化合价与负化合价代数和为6.下列说法正确的是( )| A. | R的气态氢化物能燃烧 | B. | R的最高价氧化物为RO3 | ||
| C. | R一定是第ⅦA族元素 | D. | R的气态氢化物易溶于水显碱性 |
分析 某主族元素R的最高化合价与负化合价代数和为6,设最高化合价为x,则最低化合价为x-8,则有x+x-8=6,解x=7,应位于第ⅦA族元素,则该元素的最高化合价为+7价,最低化合价为-1价,由于F元素没有最高正化合价,R不能F元素,结合对应物质的性质解答该题.
解答 解:主族元素R的最高化合价与负化合价代数和为6,设最高化合价为x,则最低化合价为x-8,则有x+x-8=6,x=7,应位于第ⅦA族元素,则该元素的最高化合价为+7价,最低化合价为-1价,由于F元素没有最高正化合价,R不能F元素.
A.R为Cl、Br等元素,对应的氢化物不能再空气中燃烧,故A错误;
B.该元素的最高化合价为+7价,R的最高价氧化物为R2O7,故B错误;
C.该元素的最高化合价为+7价,说明原子的最外层有7个电子,应位于第ⅦA族元素,故C正确;
D.R为卤族元素,对应的氢化物溶于水呈酸性,故D错误.
故选C.
点评 本题考查元素周期律与元素周期表的综合应用,难度中等,注意从化合价的角度判断元素在周期表的位置,注意对元素周期律理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.在一个2L的密闭容器中,某一反应物的物质的量为1.0mol,经过20s后,它的物质的量变成了0.6mol,在这20s内它的反应速率为( )
| A. | 0.4mol/L | B. | 0.02mol/(L•s) | C. | 0.01mol/L | D. | 0.01mol/(L•s) |
4.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示.
①b<f②915℃,2.0MPa时E的转化率为60%③该反应的△S<0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
| 压强/MPa G体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
上述①~④中正确的有( )
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
1.下列四种X溶液,分别放入盛有10mL 2mol•L -1HCl的烧杯中,加水稀释至50mL,X和HCl进行反应,其中反应速率最大的是( )
| A. | 20mL3mol•L -1X的溶液 | B. | 20mL2mol•L -1X的溶液 | ||
| C. | 10mL4mol•L -1X的溶液 | D. | 10mL2mol•L -1X的溶液 |
18.某烷烃的相对分子质量为72,跟氯气发生取代反应所得的一氯取代物有3种同分异构体,这种烷烃是( )
| A. | CH3CH2CH2CH2CH3 | B. | 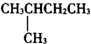 | C. | 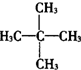 | D. | 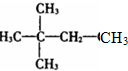 |
5.下列说法正确的是( )
| A. | 盐桥在电化学中可导通左右半池,其作用和用铜导线连接完全一致 | |
| B. | 室温时,酸碱中和滴定的终点刚好是pH=7的点 | |
| C. | pH计和广泛pH试纸的精确度一致,只是pH计使用更方便 | |
| D. | 向某溶液中滴入2滴黄色的K3[Fe(CN)6]溶液,若有蓝色沉淀生成,则溶液中一定含有 Fe2+ |
2.某电化学装置工作原理如图,下列有关说法正确的是( )
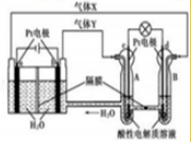

| A. | 气体X为O2 | |
| B. | c电极为负极,发生的电极反应式为H2-2e-=2H+ | |
| C. | 一段时间后A处PH降低 | |
| D. | 当有0.4mol电子转移时,在B极上生成标准状况下气体2.24L |
3.某温度下,甲溶液的pH是乙溶液的两倍,则甲溶液中H+的浓度与乙溶液中H+的浓度的关系是( )
| A. | 2:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
 .
.