题目内容
2.某电化学装置工作原理如图,下列有关说法正确的是( )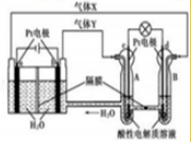
| A. | 气体X为O2 | |
| B. | c电极为负极,发生的电极反应式为H2-2e-=2H+ | |
| C. | 一段时间后A处PH降低 | |
| D. | 当有0.4mol电子转移时,在B极上生成标准状况下气体2.24L |
分析 左边的池是电解水,气体X是与电源负极相连的一极放电的产生的气体,也就是阴极生成氢气,则Y是阳极是所氢氧根离子发生氧反应得到的氧气,所以右池是氢氧酸性燃料电池,由此分析解答.
解答 解:左边的池是电解水,气体X是与电源负极相连的一极放电的产生的气体,也就是阴极生成氢气,则Y是阳极是所氢氧根离子发生氧反应得到的氧气,所以右池是氢氧酸性燃料电池,
A、气体X是与电源负极相连的一极放电的产生的气体,也就是阴极生成氢气,故A错误;
B、c极是氧气放电结合氢离子生成水,发生还原反应是正极,电极反应式为:O2+4e-+4H+=2H2O,故B错误;
C、A中发生O2+4e-+4H+=2H2O,氢离子的浓度减小,pH值变大,故C错误;
D、B中发生反应的电极反应式为:H2-2e-=2H+,所以有0.4mol电子转移时,消耗氢气0.2mol,气体的体积为2.24L,故D正确;
故选D.
点评 本题考查电化学的相关知识,难度不大,注意依据原电池的原理应用,首先考虑原电池反应所依据的氧化还原反应,再考虑产物与电解质溶液的反应.

练习册系列答案
相关题目
12.已知2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+CO2↑+H2O,现将1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热,充分反应,排出气体物质后冷却,残留的固体物质是( )
| A. | Na2CO3 | B. | Na2O2、Na2CO3 | ||
| C. | NaOH、Na2CO3 | D. | Na2O2、NaOH、Na2CO3 |
13.某主族元素R的最高化合价与负化合价代数和为6.下列说法正确的是( )
| A. | R的气态氢化物能燃烧 | B. | R的最高价氧化物为RO3 | ||
| C. | R一定是第ⅦA族元素 | D. | R的气态氢化物易溶于水显碱性 |
10.某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )


| A. | 1mol该有机物最多可以和5mol NaOH反应 | |
| B. | 1mol该有机物与浓溴水反应,最多消耗3mol Br2 | |
| C. | 该有机物容易发生加成、取代、中和、消去等反应 | |
| D. | 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 |
17.高温下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法不正确的是( )
| A. | 该反应是焓变为正值 | |
| B. | 恒温恒容下,充入更多的CO2,能提高H2的转化率 | |
| C. | 升高温度,正、逆反应速率均增大 | |
| D. | 该反应化学方程式为:CO+H2O$?_{△}^{催化剂}$ CO2+H2 |
7.二氟二氯甲烷(CF2Cl2)是甲烷的一种取代物,下列关于它的说法正确的是( )
| A. | 它有四种同分异构体 | B. | 它有两种同分异构体 | ||
| C. | 它只有一种结构 | D. | 它是平面分子 |
14.下些列有关电池的说法错误的是( )
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铅酸蓄电池中,铅电极是负极 | |
| C. | 甲醇醇燃料电池可把化学能转化为电能 | |
| D. | 铜锌原电池工作时,Zn2+沿外电路从正极流向负极 |
11.下列物质能跟镁反应并生成氢气的是( )
| A. | 常温下在蒸馏水中 | B. | 氢氧化钠溶液 | ||
| C. | 氯化铵溶液 | D. | 碳酸钠溶液 |
12.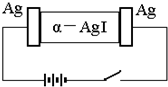 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )| A. | 若α-AgI是Ag+导电则通电一段时间后晶体密度不均匀 | |
| B. | 若α-AgI是Ag+导电则通电一段时间后晶体密度可能均匀 | |
| C. | 若α-AgI是I-导电则通电一段时间后晶体密度不均匀 | |
| D. | 若α-AgI是I-导电则通电一段时间后晶体密度仍均匀 |