题目内容
铅及其化合物工业生产及日常生活具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH= a kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH= b kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH= c kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH=kJ ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
|
温度 |
300 |
727 |
1227 |
|
lgK |
6.17 |
2.87 |
1.24 |
①该还原反应的△H0(选填:“>”“<”“=”)。
②当IgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为 。
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为 。

(4)PbI2:可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图)。加入酚酞指示剂,用0.0025mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。可计算出t℃时PbI2 Ksp为 。

(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图所示。

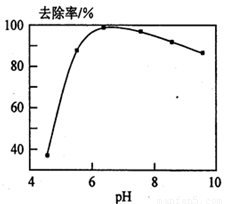
①常温下,pH=6→7时,铅形态间转化的离子方程式为 。
②用活性炭处理,铅的去除率较高时,铅主要应该处于 (填铅的一种形态的化学式)形态。
(1)2a+2b-3c
(2)①<; ②9.09%
(3)PbSO4 + 2e-= SO42-+ Pb(或PbSO4 +Ca2++ 2e-= CaSO4+ Pb)
(4)4×10-9
(5)①Pb2+ + H2O Pb(OH)+ + H+ ②Pb2+
Pb(OH)+ + H+ ②Pb2+
【解析】
试题分析:(1)依据盖斯定律,将前两式分别乘2,减去最后一式乘3,即可得所求反应的H。(2)①lgK与K为增函数关系,从表中数据知,温度越高,K越小,说明正反应放热。②lgK=1,得K=10。设开始时通入CO为amol/L,达平衡时转化了x mol/L,则平衡时,CO为(x-a)mol/L,CO2为x mol/L,由K=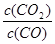 =
=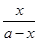 =10,解得
=10,解得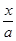 =9.09%。(3)由电池的装置图分析知,Ca作为负极,失去电子。则另一极为正极,得电子,化合价降低,即由PbSO4转化为Pb。(4)滴定过程中消耗的OH-,即为阳离子交换出来的H+,n(H+)=0.0025×20×10-3,c(H+)=n(H+)/25×10-3=2×10-3
mol/L,而C(H+)=C(I-),由PbI2的化学式知,C(Pb2+)=
C(I-)/2=10-3 mol/L,Ksp(PbI2)=c(Pb2+)c2(I-)=
10-3×(2×10-3)2=4×10-9。(5)从左图分析,当pH由6变到7时,是Pb2+向Pb(OH)+转化,即为Pb2+水解,结合水电离出的一个OH-,同时释放出一个H+。从右图看,铅的去除率最高时,pH大约为6.5左右,对比左图知,在pH=6.5时,铅主要以Pb2+存在。
=9.09%。(3)由电池的装置图分析知,Ca作为负极,失去电子。则另一极为正极,得电子,化合价降低,即由PbSO4转化为Pb。(4)滴定过程中消耗的OH-,即为阳离子交换出来的H+,n(H+)=0.0025×20×10-3,c(H+)=n(H+)/25×10-3=2×10-3
mol/L,而C(H+)=C(I-),由PbI2的化学式知,C(Pb2+)=
C(I-)/2=10-3 mol/L,Ksp(PbI2)=c(Pb2+)c2(I-)=
10-3×(2×10-3)2=4×10-9。(5)从左图分析,当pH由6变到7时,是Pb2+向Pb(OH)+转化,即为Pb2+水解,结合水电离出的一个OH-,同时释放出一个H+。从右图看,铅的去除率最高时,pH大约为6.5左右,对比左图知,在pH=6.5时,铅主要以Pb2+存在。
考点:化学反应速率与化学平衡、电解质溶液、中和滴定(氧化还原滴定)。

 全优点练单元计划系列答案
全优点练单元计划系列答案