题目内容
【题目】氧化还原是一类重要的反应。
(1)已知反应:①Cu+2Fe3+=Cu2++2Fe2+,②Cu2++Fe=Cu+Fe2+,两个反应中各种离子的氧化性从强到弱的顺序是_____________。
(2)在反应MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O中,当有0.2 mol电子转移时,产生氯气的体积(标准状况)是__________________。
MnCl2+C12↑+2H2O中,当有0.2 mol电子转移时,产生氯气的体积(标准状况)是__________________。
(3)用双线桥标出下列反应中电子转移的方向和数目_____,并指出氧化剂和还原剂。
Cl2 + SO2 + 2H2O = H2SO4 + 2HCl
氧化剂:_____________ ,还原剂:_____________;
(4)已知反应: Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
①铜与稀硝酸反应的离子方程式是_____________________________________。
②下列物质中,放到铜粉和稀硫酸中,能实现铜粉溶解的是__________。
A. KNO3 B. K2SO4 C. Cu(NO3)2
【答案】 Fe3+>Cu2+>Fe2+ 2.24L 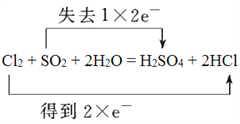 Cl2 SO2 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O AC
Cl2 SO2 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O AC
【解析】(1)在氧化还原反应中氧化剂的氧化性强于氧化物的氧化性,在根据反应①可知铁离子氧化金属铜,所以氧化性是Fe3+>Cu2+,根据反应②可知铜离子氧化金属铁,则氧化性是Cu2+>Fe2+,因此离子的氧化性从强到弱的顺序是Fe3+>Cu2+>Fe2+。(2)反应中氯元素化合价从-1价升高到0价,失去1个电子,因此生成1mol氯气转移2mol电子,则当有0.2 mol电子转移时,产生氯气的物质的量是0.1mol,在标准状况下的体积是0.1mol×22.4L/mol=2.24L。(3)氯元素化合价从0价降低到-1价,得到1个电子,氯气是氧化剂。硫元素化合价从+4价升高到+6价,失去2个电子,SO2是还原剂,因此用双线桥表示该反应中电子转移的方向和数目为 ;(4)①铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;②A、酸性溶液中硝酸根具有强氧化性,在酸性溶液中KNO3能溶解金属铜,A正确;B、K2SO4在酸性溶液中与金属铜不反应,B错误;C、酸性溶液中硝酸根具有强氧化性,在酸性溶液中Cu(NO3)2能溶解金属铜,C正确,答案选AC。
;(4)①铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;②A、酸性溶液中硝酸根具有强氧化性,在酸性溶液中KNO3能溶解金属铜,A正确;B、K2SO4在酸性溶液中与金属铜不反应,B错误;C、酸性溶液中硝酸根具有强氧化性,在酸性溶液中Cu(NO3)2能溶解金属铜,C正确,答案选AC。




