题目内容
【题目】下列图示与对应的叙述相符的是( )
A. 图甲表示可逆反应A(g)+2B(g)2C(g),速率随外界条件的改变曲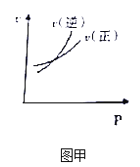
B. 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化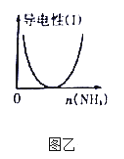
C. 图丙表示用0.1mol/L NaOH溶液滴定20.00mL 0.1mol/LCH3COOH溶液得到的滴定曲线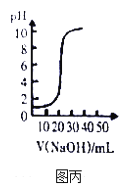
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g)相同时间后测得NO2含量的曲线,则该反应的△H<0 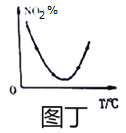
【答案】D
【解析】
A、正反应方向速率等于逆反应方向速率说明反应达到平衡,交点右侧考查影响化学平衡移动的因素,该反应是体积减小的反应,增大压强,平衡向正反应方向移动,即v正>v逆,与图甲不符合,故A错误;
B、CH3COOH是弱电解质,CH3COOH与NH3反应生成CH3COONH4,CH3COONH4为强电解质,向CH3COOH溶液中通入NH3,导电能力增强,与图乙不符,故B错误;
C、醋酸是弱酸,常温下,0.1mol·L-1的醋酸的pH>1,与图丙不符,故C错误;
D、NO2%最低时,说明反应达到平衡,最低点的右侧,升高温度,NO2%增大,平衡逆向进行,说明该反应的正向为放热反应,即△H<0,故D正确;
答案选D。

【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
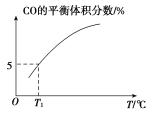
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
【题目】用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(1)已知:2SO2(g)+ O2(g)![]() 2SO3(g) △H1
2SO3(g) △H1
2NO(g)+ O2(g)![]() 2NO2 (g) △H2
2NO2 (g) △H2
NO2 (g) + SO2(g)![]() SO3(g) + NO(g) △H3
SO3(g) + NO(g) △H3
则△H3 =__________(用△H1、△H2表示),如果上述三个反应方程式的平衡常数分别为K1、 K2、K3,则K3 =__________(用K1、K2表示)。
(2)如图所示,A 是恒容的密闭容器,B 是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2mol NO 和1 mol O2通过K1、K3分别充入A、B 中,发生的反应为2NO(g)+ O2(g)![]() 2NO2 (g) [不考虑2NO2 (g)
2NO2 (g) [不考虑2NO2 (g)![]() N2 O4 (g) ],起始时A、B 的体积相同均为a L。
N2 O4 (g) ],起始时A、B 的体积相同均为a L。
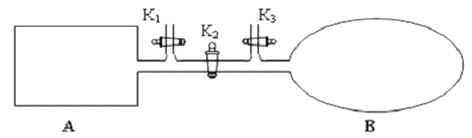
①下列说法和示意图正确,且既能说明A 容器中反应达到平衡状态,又能说明B 容器中反应达到平衡状态的是_________。
a. A、B 容器中气体的颜色均不再发生变化
b. A、B 容器中NO 和O2物质的量浓度比均为2:1

② T℃时,A 容器中反应达到平衡时的平衡常数Kp = 8×10﹣2 (kPa)﹣1。若A 容器中反应达到平衡时p(NO2) = 200kPa,则平衡时NO的转化率为_____________。(Kp 是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2和0.15 mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如 图实线 所示。
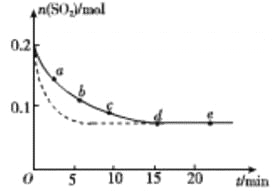
编号 | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
①ab 段平均反应速率____________(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为_________________。
②仅改变某一个实验条件,测得SO2的物质的量随时间变化如图中虚线所示,则改变的条件是__________。
【题目】关于铝热反应的现象有如下描述:反应放出大量的热,并发出耀眼的光芒;纸漏斗的下部被烧穿,有熔融物落入沙中。已知![]() 、
、![]() 、
、![]() 、
、![]() 的熔点、沸点如表所示:
的熔点、沸点如表所示:
物质 |
|
|
|
|
熔点/℃ | 660 | 1565 | 2054 | 1535 |
沸点/℃ | 2467 | 3414 | 2980 | 2750 |
(1)某同学推测,铝热反应所得到的熔融物是铁铝合金,因为该反应放热能使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验,证明上述熔融物中含有金属铝,填写下列表格:
①所用试剂 | ______ |
②实验操作及现象 | ______ |
③有关反应的化学方程式 | ______ |
(3)欲在常温下溶解该熔融物,下列试剂中最好选用______(填序号),理由是_________________________。
a.浓硫酸 b.稀硫酸 c.硫酸锌溶液d. ![]() 溶液
溶液
【题目】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为+7价 | 基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1)W的基态原子电子排布式为___,X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5(气态或液态时)中,中心原子的轨道类型不是sp3杂化的是___ (填化学式,下同),分子构型是正四面体的是___,ZX3属于___(极性分子、非极性分子)。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为___。
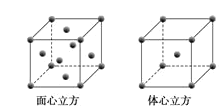
(4)Z原子的价电子轨道表示式为___。
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为rcm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为___gcm-3。