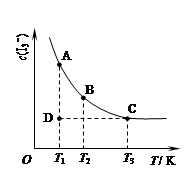题目内容
(8分)在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色) N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。

(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆) 。(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。
 N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆) 。(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。

试题分析:(1)由方程式N2O4(g)
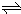 2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;(2)温度升高,正逆反应速率都增大,故答案为:加快;加快;
(3)甲中v(NO2)=0.3mol?L-1?min-1,乙中v (N2O4)=0.2mol?L-1?min-1,v(NO2)=2v(N2O4)=0.4mol?L-1?min-1,
则乙反应较快,故答案为:乙;
(4)

该反应达最大限度时,Y的转化率为:

开始时:n(X)+n(Y)=0.4mol+1mol=1.4mol,
平衡时:n(X)+n(Y)=0.7mol+0.4mol=1.1mol,
在相同条件下,气体的压强之比等于物质的量之比,
则反应开始时与反应达平衡状态时的压强之比为1.4mol:1.1mol=14:11,
故答案为:0.1mol?(L?min)-1;60%;14:11;。

练习册系列答案
相关题目

 Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。 Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( )
Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( ) 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( ) 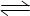 I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。