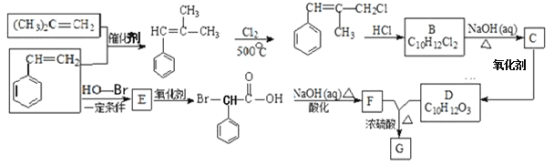
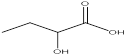
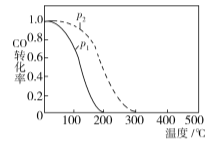
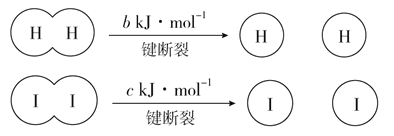
题目内容
【题目】某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
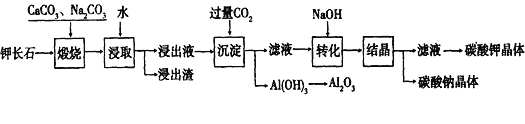
(1)煅烧过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式: _______ 。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式:________________________________。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2-+ 2H2O![]() Al(OH)3+OH-。“浸取”时应保持溶液呈____性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_______________________________________。
Al(OH)3+OH-。“浸取”时应保持溶液呈____性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_______________________________________。
(3)“转化”时加入NaOH的主要作用是(用离子方程式表示)___________________。
(4)上述工艺中可以循环利用的主要物质是 _________ 、___________和水。
【答案】(1)①CaCO3+SiO2![]() CaSiO3+CO2↑ (3分)
CaSiO3+CO2↑ (3分)
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑ (3分)
2NaAlO2+CO2↑ (3分)
3 CuCl FeCl2(3分)
② Cl-+ CuCl = [CuCl2]-(2分)
③ 4FeCO3+ O2![]() 4CO2+ 2Fe2O3(3分)
4CO2+ 2Fe2O3(3分)
④ CuCl2、 NaCl (4分)
(2)(共4分)不会产生SO2污染大气(2分),不用煅烧黄铜矿从而节约热能 [或可得副产品铁红和硫,合理答案都行。2分]
【解析】试题分析:(1)①CaCO3与SiO2高温下转化为CaSiO3,化学方程式为CaCO3+SiO2![]() CaSiO3+CO2↑;
CaSiO3+CO2↑;
②Al2O3与Na2CO3高温下转化为NaAlO2,化学方程式为Al2O3+Na2CO3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
(2)AlO2-在酸性条件下会发生反应生成铝离子或氢氧化铝沉淀,在中性条件下会发生水解,所以“浸取”时应保持溶液呈碱性,“浸取”时不断搅拌可以提高浸取速率;
(3)由流程图可知,提取碳酸钾之前得到了碳酸钠,CaCO3与SiO2;Al2O3与Na2CO3高温下都可以生成二氧化碳,所以可以循环利用的主要物质是Na2CO3、CO2。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案