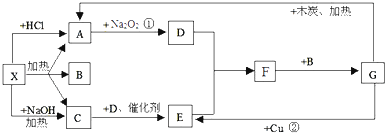
题目内容
【题目】有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子.试回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程:
(2)写出下列物质的电子式:D元素形成的单质;B与E形成的化合物;A、B、E形成的化合物;D、E形成的化合物 .
【答案】
(1)![]()
(2)![]() ;
;![]() ;Na+
;Na+![]() ;
;![]()
【解析】解:根据题意D和E可形成4核10电子的分子,可知该分子是NH3 , 因为D>E,所以D是N(氮),E是H(氢),又因为A2B中所有粒子的电子数相同,且电子总数为30所以每个离子都有10个电子.且根据化学式的结构得,B所带电荷的绝对值等于A所带的正电荷的绝对值的两倍,由A和B可以形成A2B,所以A是Na(钠),B是O(氧),因为B与C同主族,所以C可以为VIA族下面的硫.(1)氧化钠是氧离子和钠离子之间通过离子键形成的离子化合物,Na2O的形成过程为 ![]() (2)D元素形成的单质N2中含有氮氮三键,电子式可以表示为:
(2)D元素形成的单质N2中含有氮氮三键,电子式可以表示为: ![]() ,氧元素和氢元素形成的化合物水是由氢元素和氧元素之间通过共价键形成的,电子式为:
,氧元素和氢元素形成的化合物水是由氢元素和氧元素之间通过共价键形成的,电子式为: ![]() ,Na、O、H形成的化合物是NaOH,电子式为Na+
,Na、O、H形成的化合物是NaOH,电子式为Na+![]() ,H和N形成的化合物是NH3 , 电子式为:
,H和N形成的化合物是NH3 , 电子式为: ![]() ;所以答案是:
;所以答案是: ![]() ;
; ![]() ;Na+
;Na+![]() ;
; ![]() .
.

练习册系列答案
相关题目