题目内容
【题目】硫酸钠-过氧化氢-氯化钠加合物( 4Na2SO4·2H2O2·NaCl)又称固体双氧水,具有漂白、杀菌、消毒等作用,其性质较稳定,因此具有广泛的应用前景。化学实验室中制备硫酸钠—过氧化氢—氯化钠加合物的流程如下:
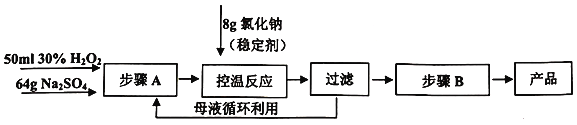
已知:过氧化氢在碱性条件下不稳定。
4Na2SO4·2H2O2·NaCl的相对分子质量为694.5。
回答下列问题:
(1)控温反应中,反应的温度控制在10℃左右,不能太高的原因是____________。
(2)可用减压过滤得到产品。减压过滤装置中的陶瓷材料仪器名称是____________。
(3)上述工艺流程中,步骤B的操作是________。
(4)硫酸钠一过氧化氢一氯化钠加合物(4Na2SO4·2H2O2·NaCl)固体比过碳酸钠(2Na2CO3·3H2O2)固体更稳定的原因是___________。
(5)准确称取8.000 g固体双氧水样品,配制成250.00mL溶液,量取25.00mL溶液于锥形瓶中,加适量稀硫酸酸化后,用0.04000mol/L KMnO4标准溶液滴定至终点,消耗KMnO4溶液20.00mL。判断滴定终点时的现象________________;产品的纯度为___________。
【答案】 温度过高过氧化氢易分解,降低过氧化氢的利用率 布氏漏斗 洗涤、干燥 过碳酸钠溶液水解呈碱性,过氧化氢在碱性条件下更易分解 溶液由无色变成红色,且半分钟内不变化 86.81%
【解析】(1)由于双氧水易分解,所以控温反应中,反应的温度控制在10℃左右,不能太高的原因是温度过高过氧化氢易分解,降低过氧化氢的利用率。(2)减压过滤装置中的陶瓷材料仪器名称是布氏漏斗。(3)过滤后的操作是洗涤、干燥。(4)由于过碳酸钠溶液水解呈碱性,过氧化氢在碱性条件下更易分解,因此硫酸钠一过氧化氢一氯化钠加合物固体比过碳酸钠固体更稳定。(5)酸性高锰酸钾溶液显紫红色,所以判断滴定终点时的现象是溶液由无色变成红色,且半分钟内不变化;消耗高锰酸钾是0.02L×0.04000mol/L=0.0008000mol,Mn元素从+7价降低到+2价,因此得到电子的物质的量是0.0008000mol×5=0.004000mol,1mol双氧水失去2mol电子,则双氧水的物质的量是0.002000mol,因此固体双氧水的质量是0.001000mol×250mL/25mL×694.5g/mol=6.945g,产品的纯度为6.945g/8.0g×100%=86.81%。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】2016年10月11日,神舟十一号飞船搭乘CZ﹣2F火箭成功发射。在重达495 吨的起飞重量中,95%的都是化学推进剂。
(1)降冰片烯![]() (C7H10)是一种重要的高密度液体燃料化学推进剂。已知:
(C7H10)是一种重要的高密度液体燃料化学推进剂。已知:
燃料 | 密度(gcm-3) | 体积热值(JL-1) |
降冰片烯 | 1.0 | 4.2×107 |
写出表示降冰片烯标准燃烧热的热化学方程式:_____。
(2)CH3OH和液氧是常用的液体火箭推进剂。
①已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H1
CH3OH(g)+H2O(l)△H1
2H2(g)+O2(l)=2H2O(l)△H2
CH3OH(g)=CH3OH(l)△H3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l)△H4
则△H4=_____(用△H1、△H2、△H3来表示)。
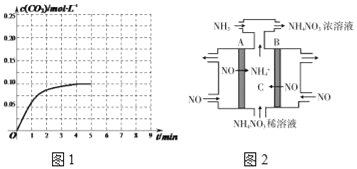
②某温度下,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1mol CH3OH和1mol H2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数_____。保持其它条件不变,在第5min时向体系中再充入0.2mol CO2和0.4mol H2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图中画出5到9min的c(CO2)变化曲线示意图。
CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1mol CH3OH和1mol H2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数_____。保持其它条件不变,在第5min时向体系中再充入0.2mol CO2和0.4mol H2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图中画出5到9min的c(CO2)变化曲线示意图。
(3)NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图2所示,A电极的名称为_____极,请写出在B电极上发生的电极反应式:_____。