题目内容
【题目】铝是地売中含量最多的金属元素,自然界中主要以Al2O3的形式存在于铝土矿中。工业上以铝土矿(主要成分是A12O3,杂质有SiO2、Fe2O3等)为原料制备金属铝,其工艺流程如图所示:
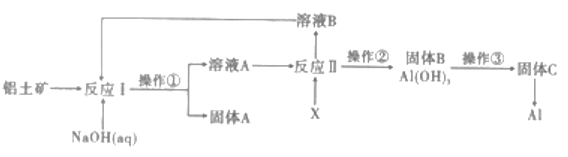
(1)操作①的名称是_________,实验室完成该操作所需的玻璃仪器主要有_________。
(2)为了提高反应的反应速率,可采取的措施有___________(答两条)
(3)调控反应I中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀。Al2O3与NaOH溶液反应的离子方程式为____________________。
(4)固体C→Al的化学反应方程式为__________________________。
(5)该生产过程中,需向反应Ⅱ中加入X
①X可为过量的CO2,则溶液B中主要的溶质是__________,为了使溶液B循环利用,应补充的物质是____________(填序号)
a. CaO b. HCl c. Na2 CO3
②X也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是___________________。
【答案】过滤 烧杯、玻璃棒、漏斗 适当增加碱溶液的浓度,将铝土矿粉碎,搅拌,加热等 Al2O3+2OH=2AlO+H2O 2Al2O3(熔融) ![]() 4Al+3O2↑ NaHCO3 a 溶液B可直接循环使用
4Al+3O2↑ NaHCO3 a 溶液B可直接循环使用
【解析】
用NaOH溶液溶解铝土矿(主要成分是A12O3,杂质有SiO2、Fe2O3等),并调控钠铝元素之比,使Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀,则过滤后得到固体A为铝硅酸钠和Fe2O3,溶液A中主要含有NaAlO2,向溶液A中通入过量CO2气体,得Al(OH)3沉淀和NaHCO3溶液,过滤后所得滤液B主要含有NaHCO3,加入CaO可制得NaOH,循环利用,将沉淀B加热灼烧得固体C为Al2O3,再电解可得Al,据此流程分析解题。
(1)操作①的目的是固液分离,应为过滤,该操作所需的玻璃仪器主要有烧杯、玻璃棒、漏斗;
(2)利用增加碱溶液的浓度,将铝土矿粉碎,搅拌,加热等措施,可提高反应的反应速率;
(3)Al2O3与NaOH溶液反应生成偏铝酸钠,反应的离子方程式为Al2O3+2OH=2AlO+H2O;
(4)利用电解Al2O3生成Al,发生反应的化学方程式为2Al2O3(熔融) ![]() 4Al+3O2↑;
4Al+3O2↑;
(5)①偏铝酸钠与过量的CO2反应生成碳酸氢钠,碳酸氢钠与氧化钙反应生成氢氧化钠,可循环使用,故答案为a;
②因Al(OH)3晶种可加速沉淀的生成,偏铝酸钠水解生成氢氧化铝和氢氧化钠,所以溶液B可直接循环使用。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案