题目内容
6.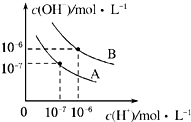 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为10:1.
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是a+b=14.
(3)在曲线B所对应的温度下,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=10.
分析 (1)先根据温度和混合溶液pH大小确定溶液的酸碱性,根据溶液的pH计算酸和碱的体积之比;
(2)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pH1与强碱的pH2之间应满足的关系;
(3)根据图象判断该温度下水的离子积,然后计算出混合液中氢氧根离子浓度,再结合该温度下水的离子积计算出所带溶液中氢离子浓度及溶液的pH.
解答 解:(1)25°C时纯水的pH=6,混合溶液的pH=7,说明酸、碱混合呈中性,pH=9的NaOH溶液c(OH-)=10-5 mol/L,pH=4的H2SO4溶液(H+)=10-4mol/L,
设酸的体积为x,碱的体积为y,10-5 mol/L×y=10-4mol/L×x,y:x=10:1;
故答案为:10:1;
(2)95℃时,pH1=a的某强酸溶液中C(H+)=10-amol/L,pH2=b的某强碱溶液c(OH-)=10b-12mol/L,溶液呈中性,则酸中氢离子的物质的量应等于碱中氢氧根离子的物质的量,则:100×10-a=1×10b-12,整理可得:a+b=14,
故答案为:a+b=14;
(3)在曲线B中,水的离子积为:10-6×10-6=10-12,0.02mol/L的Ba(OH)2溶液中c(OH-)=0.04mol/L,NaHSO4溶液的浓度为0.02mol/L,c(H+)=0.02mol/L,当二者等体积混合后,溶液中的c(OH-)=$\frac{0.04mol/L-0.02mol/L}{2}$=0.01mol/L,则c(H+)=$\frac{1{0}^{-12}}{0.01}$=10-10mol/L,该溶液的pH=10,
故答案为:10.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度较大,明确溶液酸碱性与溶液pH的关系为解答关键,(2)为易错点,需要明确该温度下水的离子积为10-6×10-6=10-12,试题充分考查了学生的分析、理解能力及化学计算能力.

| A. | 29:8:14 | B. | 22:1:14 | C. | 13:8:14 | D. | 26:6:14 |
| A. | 反应过程中CO2过量,溶液的pH<7 | B. | 水的离子积常数Kw<10-14 | ||
| C. | 2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)] | D. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| A. | 固体煤变为气体燃料后,燃烧效率将提高 | |
| B. | 化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体 | |
| C. | 直接燃烧煤不如将煤进行深加工后再燃烧的效果好 | |
| D. | 化石燃料在任何条件下都能充分燃烧 |
| A. | 15% | B. | 10.05% | C. | 9.5% | D. | 5% |
| A. | H2S→SO2 | B. | Fe2+→Fe | C. | CO${\;}_{3}^{2-}$→CO2 | D. | 2H+→H2 |
| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的百分含量 | ||
| C. | 平衡混合气的密度 | D. | 该反应的正方向的△H>0 |

