题目内容
【题目】某小组研究Na2S溶液与KMnO4溶液反应,探究过程如下。
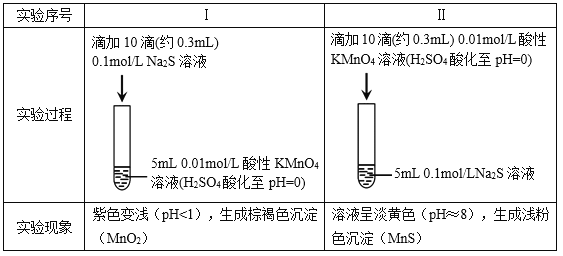
资料:ⅰ. ![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ. 单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有________性。
(2)甲同学预测实验I中S2–被氧化成![]() 。
。
①根据实验现象,乙同学认为甲的预测不合理,理由是________。
②乙同学取实验I中少量溶液进行实验,检测到有![]() ,得出S2–被氧化成
,得出S2–被氧化成![]() 的结论,丙同学否定了该结论,理由是________。
的结论,丙同学否定了该结论,理由是________。
③同学们经讨论后,设计了如下实验,证实该条件下![]() 的确可以将S2–氧化成
的确可以将S2–氧化成![]() 。
。
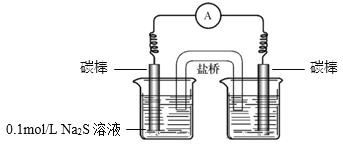
a.右侧烧杯中的溶液是________。
b.连通后电流计指针偏转,一段时间后,________(填操作和现象)。
(3)实验I的现象与资料i存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(![]() )发生反应,该反应的离子方程式是________。
)发生反应,该反应的离子方程式是________。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是______。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与________因素有关。
【答案】 还原 溶液呈紫色,说明酸性KMnO4溶液过量, ![]() 能被其继续氧化 因KMnO4溶液是用H2SO4酸化的,故溶液中出
能被其继续氧化 因KMnO4溶液是用H2SO4酸化的,故溶液中出![]() 不一定是氧化新生成的 0.01mol/L KMnO4溶液(H2SO4酸化至pH=0) 取左侧烧杯中的溶液,用盐酸酸化后,滴加BaCl2溶液,观察到有白色沉淀生成 2Mn
不一定是氧化新生成的 0.01mol/L KMnO4溶液(H2SO4酸化至pH=0) 取左侧烧杯中的溶液,用盐酸酸化后,滴加BaCl2溶液,观察到有白色沉淀生成 2Mn![]() +3Mn2+-+ 2H2O = 5MnO2↓+ 4H+ 将实验I中生成的MnO2分离洗涤后,加入0.1mol/L Na2S溶液,观察到有浅粉色沉淀,且溶液呈黄色,证明新生成的MnO2与过量的S2-反应,故没得到MnO2沉淀 浓度、用量、溶液中的酸碱性
+3Mn2+-+ 2H2O = 5MnO2↓+ 4H+ 将实验I中生成的MnO2分离洗涤后,加入0.1mol/L Na2S溶液,观察到有浅粉色沉淀,且溶液呈黄色,证明新生成的MnO2与过量的S2-反应,故没得到MnO2沉淀 浓度、用量、溶液中的酸碱性
【解析】(1)实验I中KMnO4反应生成MnO2,Mn元素由+7降到+4价,KMnO4被还原,体现了Na2S的还原性。实验II中KMnO4反应生成MnS,Mn元素由+7降到+2价,KMnO4被还原,体现Na2S的还原性。故答案为:还原性。
(2)①反应I,溶液紫色变浅,但紫色并未褪去,说明酸性KMnO4过量,KMnO4能与SO32-反应,则甲的预测不合理。故答案为:溶液呈紫色,说明酸性KMnO4溶液过量,SO32-能被其继续氧化。
②检验到溶液中存在SO42-,也不能说明S2-被氧化为SO42-,因KMnO4溶液是用H2SO4酸化的,溶液中本身就存在SO42-。
③要证明实验I中MnO4-的确将S2-氧化为SO42-,则要先排除酸性高锰酸钾溶液中SO42-的干扰。可以将MnO4-与S2-的氧化还原反应设计成带盐桥的原电池,将Na2S和酸性高锰酸钾分开反应。如图,如果能在左侧烧杯中检验到SO42-,说明S2-被氧化为SO42-。
a、由图可知,右侧烧杯中应放0.01mol/L KMnO4溶液(H2SO4酸化至pH=0);
b、根据上述分析,取左侧烧杯中的溶液,用盐酸酸化后,滴加BaCl2溶液,观察到有白色沉淀生成。
(3)根据资料i可知,在强酸性条件下MnO4-被还原为Mn2+,实验I结束后溶液依然呈强酸性,但事实上了生成了MnO2。原因是高锰酸钾过量与生成的Mn2+可以反应生成MnO2,反应离子方程式:2MnO4-+3Mn2++2H2O=5MnO2↓+ 4H+ 。
(4) 根据资料i可知,MnO4-在近中性条件下被还原为MnO2,实验II中反应结束后溶液pH≈8,接近中性,但生成了MnS。可猜测是因为过量的Na2S与一开始生成的MnO2继续反应。根据资料ⅱ,单质硫可溶于硫化钠溶液,溶液呈淡黄色,则Na2S与MnO2反应时,S2-被氧化为S单质,MnO2被还原为Mn2+。若要验证猜想,只需向MnO2中加入过量Na2S溶液,若溶液呈淡黄色,且生成浅粉色的MnS,即可证明猜想。故可设计实验方案:将实验I中生成的MnO2分离洗涤后,加入0.1mol/L Na2S溶液,观察到有浅粉色沉淀,且溶液呈黄色,证明新生成的MnO2与过量的S2-反应,故没得到MnO2沉淀。
(5)物质变化还与反应物的浓度或用量有关,反应I中KMnO4溶液过量,浓度较大,反应II中Na2S过量,浓度较大;也与溶液中的酸碱性有关,强酸性溶液时和中性时产物不同。故答案为:浓度、用量、溶液中的酸碱性。

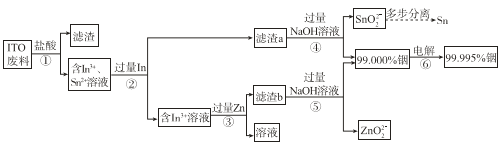
【题目】从废旧液晶显示器的主材 ITO(主要成分是含铟、锡的氧化物)回收铟和锡,流程示意图如下。
资料:
物质 | 铟(In) | 锡(Sn) |
周期表位置 | 第五周期、第IIIA族 | 第五周期、第IVA族 |
颜色、状态 | 银白色固体 | 银白色固体 |
与冷酸作用 | 缓慢反应 | 缓慢反应 |
与强碱溶液 | 不反应 | 反应 |
(1)为了加快步骤①的反应速率,可以采取的措施有______(至少答两点)。
(2)步骤①中铟的氧化物转化成In3+的离子方程式是______。
(3)步骤②中加入过量铟能够除去溶液中的Sn2+,根据所给资料分析其原因是______。
(4)步骤④和⑤中NaOH溶液的作用是______。
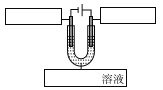
(5)下图是模拟精炼铟的装置图,请在方框中填写相应的物质。_____