题目内容
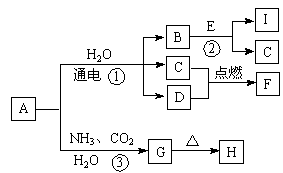
(共10分)以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。 
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)写出物质C的电子式 ;
(4)写出②、③反应的离子方程式② ,③ 。
(各2分,共10分)
(1)Al2O3;
(2)0.25mol;
(3) 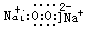
(4)②4Fe(OH)2+O2+2H2O = 4Fe(OH)3,
③2Al+Fe2O3  Al2O3 + 2Fe。(条件不扣分,离子写错0分)
Al2O3 + 2Fe。(条件不扣分,离子写错0分)
解析试题分析:由题意可知,C是Na2O2,则F 是氧气,G是NaOH;D为红棕色粉末,M为红褐色固体,则D
是Fe2O3,M是Fe(OH)3,Fe2O3与Al在高温下发生铝热反应生成Fe和Al2O3,所以A 是Fe,B是Al2O3,E是Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,所以J是氢气,I是偏铝酸钠;D是Fe2O3,H是氯化铁,与铁反应生成氯化亚铁,所以F是Fe(OH)2。
B的化学式为Al2O3,
19.5g Na2O2的物质的量是0.25mol,与水的反应中有一半作了氧化剂,一半作了还原剂,所以0.25mol过氧化钠与水反应转移电子的物质的量是0.25mol×1/2×2=0.25mol;
过氧化钠是离子化合物,其电子式为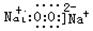 ;
;
反应②是氢氧化亚铁与氧气转化为氢氧化铁的反应,化学方程式为4Fe(OH)2+O2+2H2O = 4Fe(OH)3,反应③是铝热反应,化学方程式为2Al+Fe2O3  Al2O3 + 2Fe。
Al2O3 + 2Fe。
考点:考查物质的推断,氧化还原反应的计算,化学式、化学方程式、电子式的书写

下列各组物质中,物质之间通过一步反应就能实现图示变化的是
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① |  | FeCl2 | FeC13 | Fe | CuCl2 |
| ② | Mg | MgO | MgCl2 | Mg(OH)2 | |
| ③ | NaOH | Na2CO3 | NaHCO3 | NaCl | |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①④ B.②④ C.①③④ D.①②③
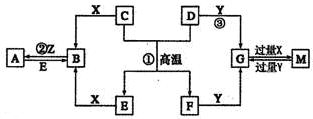
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是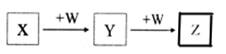
| A.若W是单质铁,则Z溶液可能是FeCl2溶液 |
| B.若W是氢氧化钠,则X与Z可反应生成Y |
| C.若X是碳酸钠,则W可能是盐酸 |
| D.若W为氧气,则Z与水作用(或溶于水)一定生成一种强酸 |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )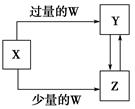
| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | 稀HNO3 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | O2 | Na |