题目内容
【题目】在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应: N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
n/mol时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s-40s内用N2O4表示的平均反应速率为_______mol/(L·s)
(2)计算在80℃时该反应的平衡常数K=_______;
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色______ (填“变浅”、“变深”或“不变”) ;
(4)要增大该反应的K值,可采取的措施有______ (填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)下列物质中: ①属于非电解质的是_____。②属于强电解质的是_____。
A.NaOH溶液 B.Cu C.液态HCl D.液态CH3COOH E.蔗糖溶液 F.液氨 G.氨水H.CuSO4晶体 I.石墨 J.无水乙醇
【答案】 0.0020 1.8mol/L 变浅 D FJ CH
【解析】(1).20s时△n(NO2)=0.24mol,故△n(N2O4)= ![]() ×△n(NO2)=
×△n(NO2)= ![]() 0.24mol=0.12mol,所以a=0.4mol0.12mol=0.28mol,故20s40s参加反应的四氧化二氮的物质的量为0.28mol0.2mol=0.08mol,则20s40s内用N2O4表示的平均反应速率为
0.24mol=0.12mol,所以a=0.4mol0.12mol=0.28mol,故20s40s参加反应的四氧化二氮的物质的量为0.28mol0.2mol=0.08mol,则20s40s内用N2O4表示的平均反应速率为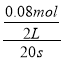 =0.0020mol/(Ls),故答案为:0.0020;
=0.0020mol/(Ls),故答案为:0.0020;
(2).由表中数据可知80s时,反应达平衡状态,由(1)中计算可知d=e=0.1mol,故c(N2O4)= ![]() =0.05mol/L,c(NO2)=
=0.05mol/L,c(NO2)= ![]() =0.3mol/L,所以该温度下平衡常数K=
=0.3mol/L,所以该温度下平衡常数K=![]() =1.8mol/L,故答案为:1.8mol/L;
=1.8mol/L,故答案为:1.8mol/L;
(3).该反应正反应是吸热反应,降低温度平衡向逆反应方向移动,NO2浓度减小,气体的颜色变浅,故答案为:变浅;
(4).平衡常数只受温度影响,要增大该反应的K值,应改变温度使平衡向正反应方向移动,该反应正反应是吸热反应,故应升高温度平衡向正反应移动,平衡常数K增大,故答案为:D;
(5).A. NaOH溶液属于混合物,既不是电解质也不是非电解质;
B. 铜是单质,既不是电解质也不是非电解质;
C. 液态HCl溶于水能完全电离导电,属于强电解质;
D. 液态CH3COOH溶于水部分电离能导电,属于弱电解质;
E. 蔗糖溶液是混合物,既不是电解质也不是非电解质;
F. 液氨溶于水能导电,是氨气与水反应生成的一水合氨电离而导电,液氨自身不能电离,所以属于非电解质;
G.氨水是混合物,既不是电解质也不是非电解质;
H.CuSO4晶体溶于水或熔融状态下能完全电离出铜离子和硫酸根离子,能导电,是强电解质;
I.石墨属于非金属单质,既不是电解质也不是非电解质;
J.无水乙醇是水溶液中和熔融状态下都不导电的化合物,属于非电解质;
根据以上分析,本题答案是: FJ;CH。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |