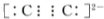题目内容
1.在一定条件下,将1molCO和1mol水蒸气通入容器中发生下述反应:CO+H2O═CO2+H2,达到平衡后,测得为CO20.6mol,再通入0.3mol水蒸气,又达到平衡后,CO2的物质的量为( )| A. | 0.7mol | B. | 0.8mol | C. | 0.6mol | D. | 0.9mol |
分析 再通入0.3mol水蒸气,平衡正向移动,二氧化碳物质的量增大,但水的转化率减小,原平衡时反应的水的物质的量等于生成二氧化碳的物质的量,则原平衡中水的转化率为60%,故新平衡中二氧化碳物质的量小于1.3mol×60%=7.8mol.
解答 解:再通入0.3mol水蒸气,平衡正向移动,二氧化碳物质的量增大,则到达新平衡时n(CO2)>0.6mol,但水的转化率减小,由方程式可知,原平衡时反应的水的物质的量等于生成二氧化碳的物质的量,则原平衡中水的转化率为$\frac{0.6mol}{1mol}$×100%=60%,故新平衡中二氧化碳物质的量小于1.3mol×60%=7.8mol,所以达到新的平衡后,CO2的物质的量介于0.6mol~0.78mol之间,
故选:A.
点评 本题考查化学平衡计算,注意利用极限法分析解答,避免计算繁琐,可以先计算平衡常数,再利用平衡常数计算具体的值.

练习册系列答案
相关题目
13.下列哪组离子能在水溶液中大量共存( )
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、Fe3+、NH4+ | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe2+、Cl-、H+、NO3- |
12.下列说法正确的是( )
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |||||||||||
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |||||||||||
| C. | 已知:
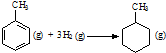 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH增大 |
9.在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2 (g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(2)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$.
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.(多选)
A.N2O4的转化率越高B.NO2的产量越大
C.N2O4与NO2的浓度之比越大D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度B.向混合气体中通入NO2C.使用高效催化剂D.升高温度
(6)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积.
| n/mol 时间/s | 0 | 20 | 40 | 60] | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$.
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.(多选)
A.N2O4的转化率越高B.NO2的产量越大
C.N2O4与NO2的浓度之比越大D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度B.向混合气体中通入NO2C.使用高效催化剂D.升高温度
(6)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积.
6.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是( )
| A. | Na2O2 | B. | CaO | C. | FeCl2 | D. | SiO2 |
13.表中除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
| 选项 | 待提纯的物质 | 选用试剂 | 操作方法 |
| A | Cu(Fe) | 稀盐酸 | 过滤 |
| B | CaO(CaCO3) | 盐酸 | 蒸发 |
| C | CO2(CO) | 石灰水 | 通入 |
| D | MgCl2溶液(盐酸) | 氢氧化钠溶液 | 滴加 |
| A. | A | B. | B | C. | C | D. | D |
10.实验中需要2.0mol/L的Na2CO3溶液950mL,配制时应选选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A. | 1000ml,212g | B. | 950ml 543.4g | C. | 950ml 201g | D. | 500ml 286g |
11.下列关于氧化物的叙述正确的是( )
| A. | 金属氧化物都是碱性氧化物 | |
| B. | 与水反应可生成含酸的氧化物都是酸性氧化物 | |
| C. | 酸性氧化物都可以与强碱反应 | |
| D. | 不能跟酸反应的氧化物一定能和碱反应 |