题目内容
12.下列说法正确的是( )| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |||||||||||
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |||||||||||
| C. | 已知:
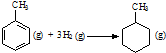 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH增大 |
分析 A、从不同状态的物质之间的转化判断,一般来说,气体转化为液体、液体转化为固体,反之吸热;
B、MgCO3溶液中,Mg2+离子和CO32-离子都能水解,水解后离子浓度不相等,存在碳酸镁固体的溶液是饱和溶液,所以在相同的温度下,溶度积常数相同;
C、反应焓变=反应物键能总和-生成物键能总和;
D、NH3•H2O溶液中加入少量NH4Cl晶体,平衡向逆方向移动,电离程度降低.
解答 解:A、气体转化为液体是放热过程,焓变为负值,则正确的表达为:H2O(g)?H2O(l)△H=-40.69kJ•mol-1,故A错误;
B、含有固体MgCO3的溶液中,是饱和溶液,Mg2+离子和CO32-离子都能水解,水解后离子浓度可能不相等,但在相同的温度下,溶度积常数不变,故B错误;
C、上表中数据进行计算,焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384kJ•mol-,故C正确;
D、NH3•H2O溶液中存在电离平衡,加入少量NH4Cl晶体,NH4+浓度增大使电离平衡向逆方向移动,电离程度降低,溶液的pH减小,故D错误.
故选:C.
点评 本题考查反应热、沉淀的溶解平衡、电离平衡等问题,掌握基础是解题关键,题目难度中等.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
5.NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 在标准状况下,22.4L CH4与22.4L H2O所含的电子数均为10NA | |
| B. | 122.5g KClO3晶体中的氯离子总数等于3NA | |
| C. | 常温常压下,总质量为28g的N2和CO的混合气体,其体积大于22.4L | |
| D. | 浓度均为0.5mol/L的盐酸和硫酸的混合溶液中,H+的物质的量为1.5mol |
17.下列关于某无色透明溶液中所含离子的检验及结论中一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定含CO32- | |
| B. | 加入氢氧化钠溶液,没有产生能使湿润的红色石蕊试纸变蓝的气体,一定没NH4+ | |
| C. | 加入氯化钡溶液无沉淀,再加入硝酸银溶液产生白色沉淀,一定含有Cl- | |
| D. | 加入硝酸钡溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,不一定含有SO32- |
4.已知热化学方程式:2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1,则关于热化学方程式:2H2O(l)═2H2(g)+O2(g)△H2=?的说法中正确的是( )
| A. | 热化学方程式中化学计量数表示分子数 | |
| B. | 该反应△H2>0 | |
| C. | 该反应的△H2=-571.6 kJ•mol-1 | |
| D. | 该反应可表示36 g水分解时的热效应 |
1.在一定条件下,将1molCO和1mol水蒸气通入容器中发生下述反应:CO+H2O═CO2+H2,达到平衡后,测得为CO20.6mol,再通入0.3mol水蒸气,又达到平衡后,CO2的物质的量为( )
| A. | 0.7mol | B. | 0.8mol | C. | 0.6mol | D. | 0.9mol |
2.t℃时,NaCl的溶解度为a g,取该温度下的饱和氯化钠溶液V mL,测得其密度为 p g/cm3,则下列表达式正确的是( )
| A. | w(NaCl)=$\frac{a}{a+100}$% | B. | n(NaCl)=$\frac{Vp}{58.5}$mol | ||
| C. | c (NaCl)=$\frac{pa}{58.5×(a+100)}$ g/mol | D. | n(NaCl)=$\frac{aVp}{58.5(a+100)}$ mol |
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置: