题目内容
【题目】I.实验室里要配制500 mL 0.2 mol/L的硫酸钠溶液。
(1)请填写下列空白:
A.计算、称量、溶解:在天平上称出________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。
B.转移:把得到的溶液冷却后小心地沿着________注入________中。
C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm ,改用_______小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
E.摇匀:将瓶塞塞紧,充分摇匀。
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(2)下列情况会使所配溶液浓度偏高的是________(填字母)。
a.某同学定容时俯时容量瓶刻度线
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线又加水了
d.进行B操作时将少量液体洒到外
II. 用质量分数为98%的浓硫酸配制100ml3.0mol/L稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④转移、洗涤⑤定容⑥摇匀 回答下列问题
(1)若所用浓硫酸密度为1.84g/cm3,则该浓硫酸的物质的量浓度为_____,配制上述稀硫酸所需浓硫酸的体积是_____(小数点后保留一位)。
(2)为了保证实验的准确性,在第③和第④步操作之间还应该加多一步什么操作_____。
【答案】 14.2 玻璃棒 500 mL容量瓶 胶头滴管 a 18.4 mol/L 16.3 mL 冷却
【解析】I. (1)需要用500mL的容量瓶,因此m(Na2SO4)=0.5L×0.2mol/L×142g/mol=14.2g,向容量瓶中转移溶液,需要沿玻璃棒向容量瓶中转移,防止液体溅出;离刻度线1~2cm时改用胶头滴管滴加,防止加水过量;(2)a、定容时俯视刻度线,所配溶液的体积减小,浓度偏高,正确;b、没有洗涤,所配溶液溶质的质量减少,浓度偏低,错误;c、加水对原溶液进行稀释,浓度偏低,错误;d、少量液体洒到外面,造成溶质的物质的量减少,所配溶液的浓度偏低,错误;答案选a。
II. (1)根据![]() 可知该浓硫酸的物质的量浓度为
可知该浓硫酸的物质的量浓度为![]() mol/L=18.4mol/L。稀释过程中硫酸的物质的量不变,则配制上述稀硫酸所需浓硫酸的体积是
mol/L=18.4mol/L。稀释过程中硫酸的物质的量不变,则配制上述稀硫酸所需浓硫酸的体积是![]() 。(2)浓硫酸溶于水放热,所以为了保证实验的准确性,在第③和第④步操作之间还应该多加一步冷却操作。
。(2)浓硫酸溶于水放热,所以为了保证实验的准确性,在第③和第④步操作之间还应该多加一步冷却操作。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】无机化合物可根据其组成和性质进行分类:
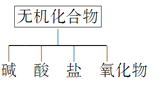
(1)上图所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥ 的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ②____ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式:______________________________。