题目内容
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
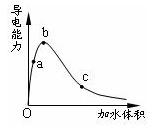

| A.a、b、c三点溶液的pH:c<a<b |
| B.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
| C.a、b、c三点中b点n(H+)最大 |
| D.a、b、c三点醋酸的电离程度:a<b<c |
D
酸电离平衡为:CH3COOH CH3COO—+H+
CH3COO—+H+
冰醋酸加水稀释过程中,电离度一直在增大,但醋酸浓度一直在减小,而c(H+)=cα;从图中可看出c(H+)是先增大后减小。而c(H+)决定了溶液的酸碱性及导电能力。但在稀释过程中,CH3COOH的量不会改变,故中和时所耗氢氧化钠的量是不会改变的。
 CH3COO—+H+
CH3COO—+H+冰醋酸加水稀释过程中,电离度一直在增大,但醋酸浓度一直在减小,而c(H+)=cα;从图中可看出c(H+)是先增大后减小。而c(H+)决定了溶液的酸碱性及导电能力。但在稀释过程中,CH3COOH的量不会改变,故中和时所耗氢氧化钠的量是不会改变的。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 2H+ + S2-
2H+ + S2- H3O++CO32-
H3O++CO32-